发布时间:2024-02-18 10:27:39 浏览 次
作者:邓乔1,周玮2,肖敏1,周辉3,廖凯婷4,廖晓棠1
单位:1 湖南省药品审评与不良反应监测中心 (湖南长沙 410013);2 湖南省药品审核查验中心 (湖南长沙 410001);3 湖南省药品检验检测研究院 (湖南长沙 410001);4 湖南省药品监督管理局 (湖南长沙 410013)
〔关键词〕抗;HPV;注册关注点;监管
〔中图分类号〕R711.74 〔文献标识码〕B
〔文章编号〕1002-2376(2024)01-0044-04
人乳头瘤病毒(human papillomavirus,HPV)是分子量较小的无包膜的双链环状 DNA 病毒,可侵染和寄生人体生殖器官及其他组织器官的上皮细胞 [1-2]。 HPV 感染是宫颈癌发生的重要因素,好发于女性生殖道 [3]。抗 HPV 类产品作为一种外用产品,通过所含有效成分表面的阴离子,与 HPV 衣壳蛋白正电荷区域结合,阻断病毒侵入阴道黏膜基底层的宿主细胞,从而达到阻断 HPV 感染的作用。本研究主要对抗 HPV 类产品从注册现状、结构组成、适用范围、产品分类等方面进行分析,并对技术审评关注点进行讨论,现报道如下。
1 抗 HPV 类产品的注册现状及问题
截至 2023 年 6 月中旬,在国家药品监督管理局官网搜索关键词“HPV”,共查询到 122 个 HPV相关产品。其中,按照医疗器械风险三类管理的Ⅲ类管理产品 32 个,均为 HPV 检测试剂盒;按照Ⅱ类管理的产品 90 个,其中用于生殖器的抗 HPV类产品 88 个,分析软件 2 个。按照Ⅱ类管理的抗HPV 类产品注册地区分布,如图 1 所示,湖南省 72 个(81.8%);广西壮族自治区 5 个(5.7%);吉林省 4 个(4.5%);山西省和海南省各 2 个,江苏省、湖北省、河南省各 1 个。从已批准的产品信息看,产品注册管理类别均为Ⅱ类,分类编码涵盖 18-01 妇产科手术器械,个别产品分类编码为:14-10 创面敷料;因此存在适用范围表述各异,部分适用范围超出Ⅱ类医疗器械范畴的问题。
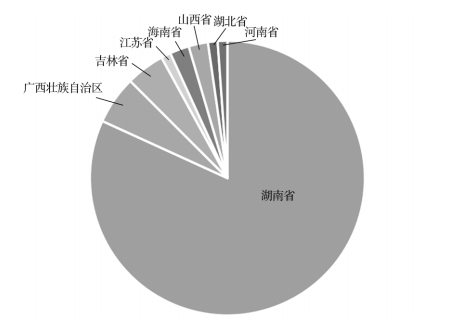
图 1 抗 HPV 类产品注册地区分布
2 抗 HPV 类产品的结构组成
已上市的抗 HPV 类产品的典型结构由抗 HPV凝胶和给药容器 2 个部分组成。凝胶成分主要包括成膜剂、pH 调节剂、润湿剂、溶剂,少部分含有抑菌防腐剂。目前已上市的抗 HPV 类产品以酸酐化 β- 乳球蛋白、β- 葡聚糖、褐藻酸盐、贻贝足丝蛋白等中的 1 种或 2 种成分为主。添加卡波姆、聚乙二醇等成膜剂,三乙醇胺、碳酸氢钠等 pH 调节剂,甘油等润湿剂,羟苯甲酯、尼泊金丙酯钠等防腐剂,再加入溶剂如纯化水等,按一定比例配比组成。目前市场上数量最多的是以酸酐化 β - 乳球蛋白为主要成分的抗 HPV 类产品,约 40 个。
3 抗 HPV 类产品适用范围
根据《医疗器械分类目录》[10],已上市的抗HPV 类产品分类编码为 18-01(妇产科手术器械),个别产品分类编码为 14-10(创面敷料)(见表 1)。18-01-13 凝胶产品的描述为“通常由卡波姆、明胶、低聚异麦芽糖等组成”。
表 1 抗 HPV 产品注册类别(个)
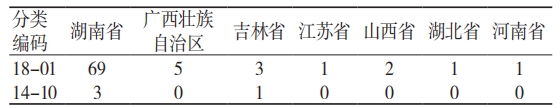
注:18-01 为妇产科手术器械,14-10 为创面敷料
目前,市场上的抗 HPV 类产品成分相对复杂,预期用途也存在差异。据统计,预期用途为“用于降低局部 HPV 病毒载量”的产品数量最多,约占全部 HPV 类产品的 61%。
4 产品分类
该类产品未被《医疗器械分类目录》(2017 年)收录,但在国家药品监督管理局医疗器械标准管理中心分别于 2018、2020 年发布的分类界定汇总文件中 [4-5] 对其进行了相关描述,见表 2。
表 2 产品分类界定文件

由上述分类界定汇总文件可知,在对该类产品类别属性界定时应注意:一是产品作用机制应为有效成分所带阴离子与 HPV 衣壳蛋白正电荷区域结合,阻断病毒侵入阴道黏膜基底层的宿主细胞,从而达到阻断 HPV 感染的物理作用;二是产品不能因产生抗 / 抑菌作用,从而抑制 HPV 病毒活性;三是预期用途仅为“用于降低局部的 HPV 载量”。只有同时满足上述条件,该类产品才能按照Ⅱ类医疗器械管理。
另外,国家药品监督管理局医疗器械标准管理中心于 2023 年 8 月发布了《关于征求〈医用阴道凝胶(液、栓)类产品分类界定指导原则(征求意见稿)〉意见的通知》[6],其中明确提到界定抗HPV 类产品类别属性应注意以下特征。(1)通过所含特异性免疫球蛋白,特异性的与 HPV 结合从而降低局部 HPV 载量的产品不作为医疗器械管理。(2)产品一方面通过产品表面所带有的负电荷,与 HPV 的正电荷发生静电吸附,在一定程度上阻断 HPV 病毒进入宿主靶细胞,降低局部 HPV 载量;另一方面还通过所含成分发挥药理学、免疫学或代谢作用的产品按药械组合产品管理。(3)产品仅通过产品表面所带有的负电荷与 HPV 的正电荷发生静电吸附,在一定程度上阻断 HPV 病毒进入宿主靶细胞,仅用于降低局部 HPV 载量,按照Ⅱ类医疗器械管理。
以上均可作为抗 HPV 类产品类别判定的参考依据,但最终的产品分类需根据产品具体情况而定。
5 抗 HPV 类产品注册技术关注点
临床根据 HPV 不同亚型致病力或不同致癌危险性,可将 HPV 分为高危型和低危型两大类。低危型 HPV 主要引起肛门皮肤及男性外生殖器、女性大小阴唇、尿道口、 阴道下段的外生性疣类病变和低度子宫颈上皮内瘤,其病毒亚型主要有 HPV6、11、40、42、43、44 型。 高 危 型 HPV 除 引 起外生殖器疣外,更重要的是可引起外生殖器癌、宫颈癌及高度子宫颈上皮内瘤变,其病毒亚型主要有HPV 16、18、31、33、35、39、45、51、52、56、58、59、68 型。有研究表明,约 70% 的子宫颈癌是由于感染 HPV 16 或 HPV 18 引起。抗 HPV 类产品可降低 HPV 载量,应先明确其使用部位(如男或女性生殖器等)、使用方式、作用时间(应关注凝胶剂与冲洗剂的作用时间)等。
目前暂无抗 HPV 类产品相关国家标准、行业标准及技术指导原则,而 HPV 感染率又日益高发,现结合以上已批准产品的注册证信息及国家相关要求和文献检索,从产品结构组成、有效成分含量、适用范围、原材料、产品技术要求制定、生物学特性及临床评价资料等方面进行分析,以供监管部门和注册申请人在此类产品监管及研发时参考。
5.1 结构组成
注册产品中除有效成分外,可能还包括成膜剂、保湿剂、pH 调节剂、抑菌防腐剂等多种成分。明确产品中是否含有药物成分、中药材(或天然植物)及其提取物等,如有,需要说明这些成分不发挥药理学、免疫学或代谢作用,并提供必要的证明资料。
5.2 有效成分含量
抗 HPV 类产品关键在于添加起主要作用的有效成分(如褐藻酸盐等),作为该类产品的有效性关键指标。建议在产品技术要求性能指标中制定有效成分鉴别、含量等指标,并选择合适的检验方式对上述性能进行检验。
5.3 适用范围
根据国家药品监督管理局医疗器械标准管理中心分类界定汇总文件规定,该类产品作为Ⅱ类医疗器械管理时,其预期用途仅为“用于降低局部的HPV 载量”。
5.4 原材料
由于抗 HPV 类产品的特殊性,申报时应说明原材料的选择依据,明确产品的起始材料,列明产品生产过程中由起始材料至终产品所需全部材料(包括添加剂、助剂等)的基本信息,如部件、化学名称、商品名 / 材料代号、化学结构式 / 分子式、供应商、生产商、符合的标准等。
5.5 技术要求
产品的性能指标和检验方法的制定是产品研发的核心点,可参照已上市同品种产品、《中国药典》或其他相关标准制定。在制定抗 HPV 类产品技术要求时,应充分阐述性能指标确定的原因、依据及理论基础。该类产品除了基本的外观、尺寸 / 装量、理化性能、重金属、微生物限度等性能指标外,还应着重考虑有效成分鉴别、含量等指标。若产品宣称其他性能,如成膜性、阻菌性、无菌供应等,应设置相关性能指标及试验方法。
5.6 生物学特性研究及生物源材料的安全性研究
按照第Ⅱ类医疗器械管理的用于阴道给药的抗HPV 类产品,与人体接触的形式为与阴道完整黏膜接触,评价接触时间应当计算累计接触时间。注册申请人应考虑产品临床应用的有效性,对产品使用时间开展研究,若产品与阴道黏膜表面累计接触时间不超过 24 h,根据 GB/T 16886.1-2022《医疗器械生物学评价 第 1 部分:风险管理过程中的评价与试验》系列标准,应考虑产品生物学评价终点包括细胞毒性、致敏、刺激或皮内反应。若产品与阴道黏膜表面累计接触时间在 24 h~30 d,应考虑产品生物学评价终点包括细胞毒性、致敏、刺激或皮内反应、急性全身毒性、亚急性毒性、植入反应。若产品结构组成含采用动物组织衍生物或由动物体自然获取物质(例如:牛奶等)注册申报资料应符合《动物源性医疗器械注册技术审查指导原则(2017 年)修订版》要求。
5.7 临床评价资料
该类产品临床评价应符合《医疗器械临床评价指导原则》[7] 等临床评价相关技术指导原则的要求。根据国家药品监督管理局《免于临床评价医疗器械目录的通告》(2023 年第 33 号)[8] 中规定,18 子目录下Ⅱ类无源产品均免于进行临床评价,但该通告中的 18 子目录下Ⅱ类无源产品并不涵盖 18-01-13凝胶类产品。另外,在《医疗器械分类目录》[9] 子目录 18“妇产科、辅助生殖和避孕器械”相关产品临床评价推荐路径文件中,也无 18-01-13 凝胶类产品的临床评价路径。因此,不建议此类产品按照免于临床评价路径提交临床评价资料。
若申报产品采用同品种对比路径开展临床评价时,应按照《医疗器械临床评价等同性论证技术指导原则》论证对比器械与申报产品在适用范围、技术和生物学特性方面的等同性。论证申报产品与对比器械具有等同性,方可通过等同器械的临床数据进行临床评价。
若申报产品采用临床试验路径开展临床评价时,可参考《医疗器械临床试验设计指导原则》[10]、《医疗器械临床试验质量管理规范》[11]、《医疗器械临床试验数据递交要求注册审查指导原则》[12] 等要求开展临床试验。
6 总结
HPV 感染是宫颈癌的主要原因,即 HPV 是宫颈癌发生的必要条件。为了满足临床诊疗需求,抗 HPV 类产品的成为医疗器械产品中较新的类别。本研究结合国家药品监督管理局对该类产品现行要求及已批准产品的注册现状、产品结构组成、产品适用、产品分类等方面问题情况进行分析,希望能为此类产品的注册、监管及研究提供一定的思路,为此类产品质量评价体系的完善提供参考。
【参考文献】
[1]Villa LL, Bernard HU, Kast M, et al. Past, present, and future of HPV research: highlights from the 19th International Papillomavirus[J]. Conference-HPV2001,2002, 89: 163-173.
[2]Saslow D, Runowicz CD, Solomon D, et al. Anleriean Cancer Soeiety Guideline for the early detection of cervical neoplasia and cancer, CA Cancer[J]. Clin, 2002(52): 342-362.
[3]万磊,万建平,张燕玲 . 子宫颈癌年轻化趋势的临床分析 [J]. 中国肿瘤临床,2004(10):547-549.
[4]国家药品监督管理局医疗器械标准管理中心 . 2018年医疗器械产品分类界定结果汇总 [EB/OL]. [2019-02-18]https://www.nifdc.org.cn//nifdc/bshff/ylqxbzhgl/qxxxgk/fljd/20190218152201546.html.
[5]国家药品监督管理局医疗器械标准管理中心 . 2020年第二批医疗器械产品分类界定结果汇总 [EB/OL]. [2020-09-30]https://www.nifdc.org.cn//nifdc/bshff/ylqxbzhgl/qxxxgk/fljd/20200930105343181.html.
[6]国家药品监督管理局医疗器械标准管理中心 . 关于征求《 医用阴道凝胶(液、 栓)类产品分类界定指导原则(征求意见稿)》意见的通知 [EB/OL]. [2023-08-22]https://www.nifdc.org.cn//nifdc/bshff/ylqxbzhgl/qxzqyj/20230822084616722283.html.
[7]国家药品监督管理局 . 关于发布医疗器械临床评价技术指导原则等5项技术指导原则的通告(2021年第73号)[EB/OL].[2021-09-28]https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20210928170338138.html.
[8]国家药品监督管理局 . 关于发布免于临床评价医疗器械目录的通告(2023年第33号)[EB/OL]. [2023-07-24]https://www.cmde.org.cn//flfg/fgwj/tz/20230725085258194.html.
[9]国家食品药品监督管理总局 . 关于发布医疗器械分类目录的公告(2017年 第104号)[EB/OL]. [2017-09-04] https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20170904150301406.html.
[10]国家食品药品监督管理总局 . 关于发布医疗器械临床试验设计指导原则的通告(2018年第6号)[EB/OL]. [2018-01-08]https://www.nmpa.gov.cn/xxgk/ggtg/ylqxggtg/ylqxqtggtg/20180108183301635.html.
[11]国家药监局 国家卫生健康委 . 关于发布 《医疗器械 临 床 试 验 质 量 管 理 规 范》的 公 告(2022年 第 28 号)[EB/OL]. [2022-03-31]https://www.nmpa.gov.cn/xxgk/fgwj/xzhgfxwj/20220331144903101.html.
[12]国家药品监督管理局 . 关于发布医疗器械临床试验数据递交要求等2项注册审查指导原则的通告(2021年 第91号 ) [EB/OL].[2021-11-25]https://www.nmpa.gov.cn/xxgk/ggtg/ylqxgg tg/ylqxqtggtg/20211125173931195.html.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号