发布时间:2025-04-29 08:57:23 浏览 次
作者:邢娣娣,马宁,刘华,盖璐楠,齐佳钰,甄晓兰(通信作者)
单位:河北省药品医疗器械检验研究院 (河北石家庄 050227)
〔关键词〕尿酸;体外诊断试剂盒;抗干扰
〔中图分类号〕R446.6 〔文献标识码〕B
〔文章编号〕1002-2376(2025)04-0034-05
基金项目:河北省药品监督管理局科技计划项目(2022ZC1035)
尿酸作为嘌呤代谢的关键产物,与肾病、心脏病等多种疾病存在密切联系。尿酸不仅是诊断痛风的重要指标,临床有研究表明高尿酸血症还与心脑血管疾病、急性心肌梗死等疾病直接相关,因此,尿酸的准确测定对于疾病的诊断和治疗具有重要意义 [1-8]。尿酸的检测方法包含电化学法,酶化学法,质谱法等 [9-11]。目前,尿酸检测试剂盒普遍采用尿酸酶 - 过氧化物酶法。该方法利用尿酸在尿酸酶作用下生成尿囊素、二氧化碳和过氧化氢,过氧化氢与酚和 4- 氨基安替比林在过氧化物酶的催化下发生氧化反应,生成红色的苯醌亚胺 [12-14]。
在临床诊断中,体外诊断试剂盒如果对内源性干扰物质的抗干扰能力不足,可能会导致检测结果偏差,进而影响临床的诊断及治疗决策,尤其是样本中存在多种潜在干扰物质时,提高试剂盒的抗干扰能力显得尤为重要 [15-16]。基于此,本研究旨在通过评价尿酸检测试剂盒的抗干扰能力,以期为临床实验室选择更优质的检测试剂盒提供指导。
1 材料和方法
1.1 材料
本研究选取 7 家生产企业的某个批次已上市销售的尿酸检测试剂盒(编号 1~7)为研究对象。
试验仪器:日立 7180 全自动生化分析仪。
试验试剂。(1)国际标准品:美国 SRM 909c,靶值 0.278 mmol/L。(2)国家标准品 1:尿素、尿酸和总蛋白复合冰冻人血清(国家标准品批号:360012-201601,靶值:288.68 μmol/L,中国食品药品检定研究院研制)。(3)国家标准品 2:冰冻人血清中尿酸(UA)标准物质 [ 编号:GBW(E)090935,靶值:420 μmol/L, 北京市医疗器械检验所研制 ]。(4)干扰物:维生素 C(国家标准品批号:100425-202105,靶值:100 mg / 支)、总胆红素冰冻人血清国家标准品(国家标准品批号:360033-201901,靶值:22.60 μmol/L)、肌酐冰冻人血清国家标准品(国家标准品批号:360050-202101,靶值:308.8 μmol/L),均为中国食品药品检定研究院研制。
1.2 方法
选取 2 份临床样本,1 份尿酸测定结果正常(约 200 μmol/L),另 1 份结果异常(约 500 μmol/L)作为基准样本。将每份基准样本分为 N 个等份,其中 1 份作为对照组(即不添加任何干扰物质),其余样本分别加入不同浓度的干扰物质。所有样本均重复测定 3 次,计算每个浓度下干扰物质的测定均值与对照组的相对偏差,评估尿酸检测试剂盒的抗干扰能力。
在临床样本配制中注意以下 3 点。(1)高浓度维生素 C 采用国家标准品配制,最终浓度为1 818 μmol/L,其余的干扰物质按照使用说明书复溶后直接使用。(2)不同浓度的干扰物质是通过临床样本和干扰物质按照不同比例混合得到。其中,维生素 C 和临床样本按照 1‥1、1‥4、1‥9、1‥20 的比例混合,分别得到含维生素 C 浓度为909、364、182、86 μmol/L 的临床样本;总胆红素和临床样本按照 1‥0.1、1‥5.0 的比例混合,分别得到含总胆红素浓度为 20.55、3.77 μmol/L的临床样本;肌酐和临床样本按照 1‥2.4、1‥5.0 的比例混合,分别得到含肌酐浓度为 90.8、51.5 μmol/L 的样本。(3)由于维生素 C 的基质效应对尿酸检测结果有较大影响 [17-18],为保证检测结果的准确,本研究使用的校准品均为试剂盒配套校准品。
1.3 准确度检测
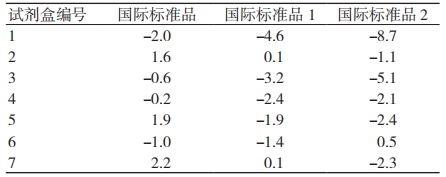
使用 3 种不同的国家和国际标准品对试剂盒的准确度进行检测,结果显示试剂盒的准确度均在±9.0% 以内(图 1、见表 1),符合现行的 YY/T 1207—2013《尿酸测定试剂盒(尿酸酶过氧化物酶偶联法)》[19] 中关于准确度的要求(使用具有溯源性的标准品进行测定,实测值与标示值的相对偏差应在 ±10.0% 内)。
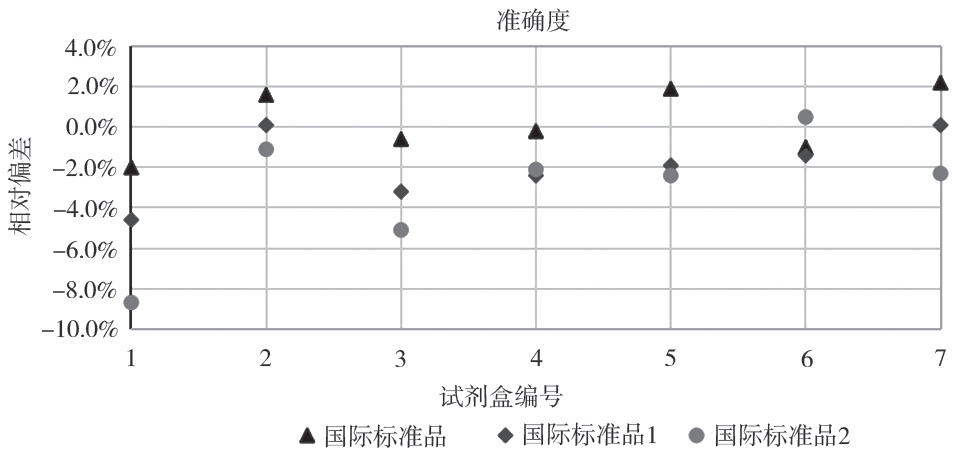
图 1 准确度检验结果
表 1 尿酸检测试剂盒准确度(相对偏差)检测结果(%)
1.4 尿酸检测试剂盒的抗干扰能力
根据 WS/T 403—2012《临床生物化学检验常规项目分析质量目标》[20],将检测偏差 ±4.5% 作为可接受标准。如果检测偏差在 ±4.5% 以内,则认为尿酸检测试剂盒具有较强的抗干扰能力;否则,抗干扰能力较弱。
2 结果
2.1 尿酸检测试剂盒抗维生素 C 干扰能力
在尿酸样本中加入抗维生素 C 后不同编号试剂盒对抗坏血酸的抗干扰能力存在显著差异,见表 2。5 号试剂盒抗维生素 C 干扰能力最强,维生素 C 浓度为 909 μmol/L 时,相对偏差仍在 3% 以内;4 号试剂盒抗维生素 C 干扰能力最差,维生素 C 浓度低于 86 μmol/L 时,相对偏差就已经超过 ±4.5%。低浓度尿酸的检测结果对维生素 C 更为敏感。
表 2 试剂盒抗维生素 C 干扰检测结果
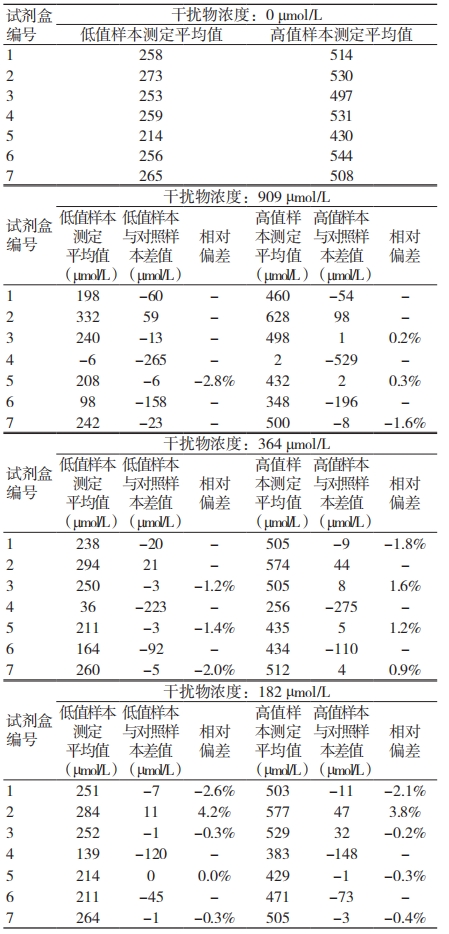
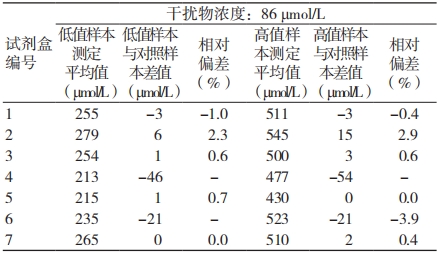
注:- 表示相对偏差超过 ±4.5%
2.2 尿酸检测试剂盒抗总胆红素干扰能力
总胆红素对尿酸检测试剂盒产生负向干扰,当干扰物浓度为 3.7、20.5 μmol/L 时,相对偏差均超过 -4.5%。见表 3。
表 3 试剂盒抗总胆红素干扰检测结果
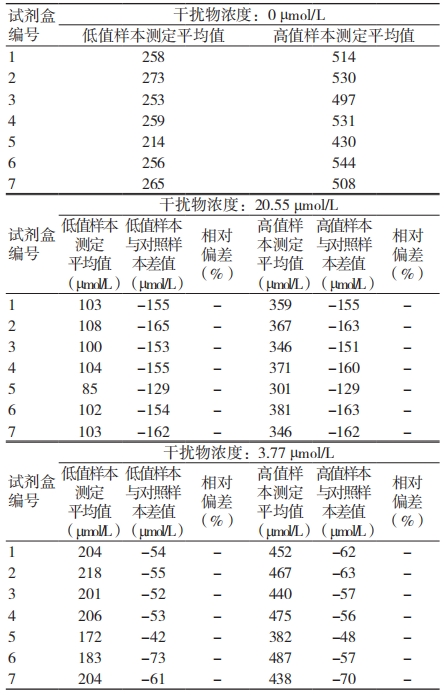
注:- 表示相对偏差超过 ±4.5%
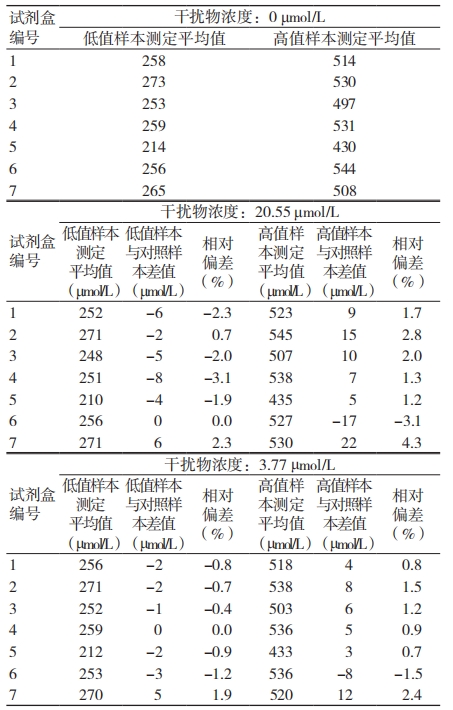
2.3 尿酸检测试剂盒抗肌酐干扰能力
尿酸检测试剂盒对肌酐具有较好的抗干扰能力, 当干扰物浓度为 0、90.8、51.5 μmol/L 时,检测结果几乎均不受肌酐干扰,相对偏差均在 ±4.5% 以内。见表 4。
表 4 试剂盒抗肌酐干扰检测结果
3 讨论
准确度是衡量试剂盒质量的核心指标及评价试剂盒性能的重要指标之一,可评价试剂盒检测结果趋于真实值的程度。准确度的偏差过大说明检测值和真实值相差较大,偏差过大就不能反映临床患者的真实生化指标,准确度高低直接关系到患者的疾病诊断与治疗方案的制定 [21-25]。本研究准确度测试结果显示,所选取的 7 个生产企业的试剂盒对 3 种不同标准品的检测相对偏差均在 ±9% 以内,符合行业标准的要求,表明试剂盒在无干扰条件下的检测可信度较高。在此前提下,本研究开展尿酸检测试剂盒对维生素 C、总胆红素、肌酐的抗干扰能力评价。
目前,临床所用的尿酸检测试剂盒通常为尿酸酶法,中间产物过氧化氢和终产物苯醌亚胺具有氧化性,会与具有还原性的维生素 C 发生反应,从而影响尿酸检测结果的准确度 [26-27]。本研究结果显示,在尿酸样本中加入维生素 C 后不同生产厂家的试剂盒对维生素 C 的抗干扰能力存在显著差异,其中 1 家试剂盒(5 号)对维生素 C 的抗干扰能力较强,当维生素 C 浓度为 909 μmol/L 时,仍对其有较高的抗干扰能力;1 家试剂盒(4 号)对维生素 C 的抗干扰能力较弱,当维生素 C 浓度低于 86 μmol/L 时,相对偏差仍在 ±4.5% 以上;其余 5 家生产企业试剂盒的抗干扰能力则根据维生素 C 浓度变化而不同。由于维生素 C 氧化酶可与维生素 C 发生反应,因此可通过在尿酸检测试剂盒中添加维生素 C 氧化酶的方法减弱其对尿酸检测结果的干扰,这也是目前商品化的试剂盒常采用的消除维生素 C 干扰的方法。5 号尿酸检测试剂盒中的试剂中含有维生素 C 氧化酶,因此其抗维生素 C 干扰性能最强。但需要注意的是,当样本中维生素 C 浓度过高时维生素 C 氧化酶的作用会减弱,需要将样本稀释后进行检测。
总胆红素可与过氧化氢发生反应,导致 400 ~540 nm 波长下吸光度的下降,从而掩盖主反应吸光度的增高,同时中间产物的消耗导致有色的终产物生成量减少,最终使尿酸检测量偏低,从而尿酸检测结果偏低 [28-29]。本研究结果显示,当样本中总胆红素含量为 3.77 µmol/L 时会产生严重的负向干扰,而成年人总胆红素正常值通常为3.4 ~ 17.1 µmol/L,因此总胆红素对所检测的 7 批次尿酸检测试剂盒的检测结果产生显著干扰,总胆红素对尿酸检测结果的影响不容忽视。检测时,可通过在试剂中添加总胆红素氧化酶的方法提高试剂盒的抗干扰能力,或是将样本稀释后进行检测。
肌酐是人体肌肉的代谢产物,可稀释至血液中随尿液排泄。本研究结果显示,选取的 7 批次尿酸检测试剂盒对肌酐的抗干扰能力均较强,当肌酐的浓度达 90.8 µmol/L 以上时,相对偏差仍保持在 ±4.5% 以内,说明尿酸检测试剂盒抗肌酐干扰能力较强,因此肌酐对尿酸检测结果的影响可忽略不计。
综上所述,实际工作中需根据试剂盒的抗干扰能力选择可满足临床检验要求的试剂盒,如果同时存在可对尿酸检测结果产生干扰的样本,应选择对干扰物质抗干扰能力较强的试剂盒或采取稀释的办法,尽量将干扰程度降至最低;同时,在实际检验工作中,应避免不同生化检测项目之间的交叉污染,特别是当使用生化分析仪进行检验时,要经常清洗样本针、搅拌棒等部件,保证仪器的清洁。另外,生产企业可通过添加抗干扰物质等方法提高产品的抗干扰能力性能。
【参考文献】
[1]Guo JH. Uric acid monitoring with a smartphone as the electrochemical analyzer[J]. Anal Chem, 2016, 88(24): 11986-11989.
[2]Chattaraj KG, Paul S. The miscibility and solubility of uric acid and vitamin C in the solution phase and their structural alignment in the solid–liquid interface[J]. Phys Chem Chem Phys, 2021, 23(28): 15169-15182.
[3]田娜妮,何青青 . 吡嗪酰胺相关高尿酸血症的影响因素分析 [J]. 中国医药导刊,2022,24(4):389-392.
[4]王子韬,向婷 . 血尿酸与类风湿关节炎相关间质性肺病的关系研究 [J]. 实用心脑肺血管病杂志,2022,30(3):64-69.
[5]Qu SM,Li Z, Jia Q. Detection of Purine Metabolite Uric Acid with Picolinic-Acid-Functionalized Metal-Organic Frameworks[J]. ACS App Mater Interfaces, 2019, 11(37): 34196-34202.
[6]张凤阳,邢志华 . 基于尿酸转运蛋白的中药治疗高尿酸血症的研究进展 [J]. 中南药学,2022,20(5):1123-1128.
[7]Cheng SP, Khan M,Yin FC. Liquid crystal-based sensitive and selective detection of uric acid and uricase in body fluids[J]. Talanta, 2022(244): 123455.
[8]李炳霞 . 血清尿酸的的测定与临床意义 [J]. 中国现代药物应用,2012,6(5):44-45.
[9]邹瑟音,雷达,凌连生,等 . 基于尿酸酶 - 钯纳米粒子的比色分析定量检测血清尿酸的方法建立及初步应用评价 [J]. 国际检验医学杂志,2021,42(6):653-655,660.
[10]周晓娜,方宏罡,曹艳菲 . 尿酸酶 - 过氧化物酶偶联反应检测血清尿酸过程中的干扰分析 [J] 诊断学理论与实践,2020,19(4):426-429.
[11]Zhao LL, Blackburn J, Brosseau C. Quantitative Detection of Uric Acid by Electrochemical-Surface Enhanced Raman Spectroscopy Using a Multilayered Au/Ag Subtrate [J]. Anal Chem, 2015, 87(1): 441-447.
[12]黄华翠,黄学斌 . 血尿酸检测国产试剂盒与进口试剂盒性能比对研究 [J]. 检验医学与临床,2011,8(10):1229-1230.
[13]金鹤成 . 三酰甘油、尿酸试剂盒抗还原型干扰能力的评价 [J]. 上海医学检验杂志, 2001,16(2):111-112.
[14]Huang SH, Shin YC,Wu CY. Detection of serum uric acid using the optical polymeric enzyme biochip system[J]. Biosens Bioelectron, 2004, 19(12): 1627-1633.
[15]李静静,丁显平 . 探讨临床体外诊断 试剂抗干扰能力验证方案的建立 [J]. 心理医生, 2017,23(3):86-88.
[16]张开红,乔慧,李鹏,等 . 胆碱酯酶检测试剂对尿酸结果的干扰一例分析 [J]. 山西医药杂志,2020,49(23):3318-3320.
[17]张江涛,曾洁,马嵘,等 . 血清尿酸测定的基质效应 [J]. 检验医学,2016,31(8):635-639.
[18]阿布都热西提·吐尔送托合提,沙代提汗·木沙,布危坚奶提·托合提如则 . 血清尿酸测定的基质效应 [J]. 世界最新医学信息文摘,2017,17(75):118.
[19]国家食品药品监督管理总局 . 尿酸测定试剂盒(尿酸酶过氧化物酶偶联法):YY/T 1207—2013[S]. 北京:中国标准出版社,2014.
[20]中华人民共和国卫生部 . 临床生物化学检验常规项目分析质量目标:WS/T 403—2012[S]. 北京:中国标准出版社,2013.
[21]欧阳伟庆,李嘉燕 . IgM-k 型 M 蛋白对尿酸检测的干扰及解决方案 [J]. 检验医学与临床,2022,19(8):1147-1149.
[22]柯杰弛,潘晓芳 . 临床化学体外诊断试剂盒性能评价指标 [J]. 医药卫生,2020(8):103,105.
[23]徐伟文 . 体外诊断试剂研制常用技术指标之分析性能评估 [J]. 分子诊断与治疗杂志,2010,2(2):140-144.
[24]高飞,胡泽斌,孙楠,等 . 尿素测定试剂盒质量分析探索 [J]. 中国医药生物技术,2021,16(6):553-555.
[25]姜肖玉,赵卫新 . 试剂交叉污染对尿酸检测结果的干扰 [J]. 检验医学与临床,2012,9(3):351-352.
[26]国秀芝,张江涛,侯立安,等 . 羟苯磺酸钙对尿酸酶 - 过氧化物酶偶联法尿酸检测的干扰研究 [J]. 中华检验医学杂志,2015,38(9):600-604.
[27]王梅英,石日东 . 血清维生素 C 浓度对尿酸测定结果的影响 [J]. 临床合理用药,2020,13(1):167-168.
[28]高应东,朱成宾,窦露,等 . 高浓度胆红素对血清尿酸测定的干扰分析及解决方法 [J]. 国际检验医学杂志,2013,34(8):1003-1004.
[29]潘亚丽 . 尿酸测定试剂的抗干扰能力研究 [J]. 生物化工,2022,8(1):118-121.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号