一、前言
医疗器械货架有效期是指保证医疗器械终产品正常发挥预期功能的期限,一旦超过医疗器械的货架有效期,就意味着该器械可能不再满足已知的性能指标,发挥预期功能,在使用中具有潜在的风险。为进一步明确无源植入性医疗器械产品注册申报资料的技术要求,指导注册申请人编制无源植入性医疗器械货架有效期注册申报资料,特制定本指导原则。无源非植入性医疗器械有关货架有效期注册申报可根据实际情况参照执行。
本指导原则系对无源植入性医疗器械货架有效期的一般性要求,未涉及其他技术要求。对于产品其他技术要求有关注册申报资料的准备,注册申请人还需参考相关的法规和指导性文件。如有其他法规和指导性文件涉及某类医疗器械货架有效期的具体规定,建议注册申请人结合本指导原则一并使用。
本指导原则系对注册申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行。如果有能够满足相关法规要求的其他方法,也可采用,但应提供详细的研究资料和验证资料。注册申请人应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
本指导原则是国家食品药品监督管理局2011年发布的《无源植入性医疗器械货架寿命申报资料指导原则》的修订版。本次修订主要涉及以下内容:(一)将原《指导原则》中的“货架寿命”改为“货架有效期”;(二)调整了部分文字表述;(三)修改了植入性医疗器械的定义,保持与《医疗器械分类规则》(国家食品药品监督管理总局令第15号)一致。
二、适用范围
本指导原则主要适用于无源植入性医疗器械货架有效期的研究及相关注册申报资料的
准备。
三、基本要求
(一)货架有效期影响因素
影响医疗器械货架有效期的因素主要包括外部因素和内部因素。此处列举了部分与无源植入性医疗器械密切相关的影响因素,但不仅限于以下内容:
外部因素主要包括:
1. 储存条件,例如温度、湿度、光照、通风情况、气压、污染等;
2. 运输条件,例如运输过程中的震动、冲撞;
3. 生产方式,采用不同方式生产的同一医疗器械产品可能具有不同的货架有效期;
4. 生产环境,如无菌医疗器械生产场所的洁净度、温度和湿度、微生物及悬浮粒子负
荷等;
5. 包装,例如在不同尺寸容器中包装的产品可能具有不同的货架有效期;
6. 原辅材料来源改变的影响,如采购单位、采购批号改变;
7. 其他影响因素,如生产设备改变的影响及设备所用清洗剂、模具成型后不清洗的脱模剂的影响。
内部因素主要包括:
1. 医疗器械中各原材料/组件的自身性能,各原材料/组件随时间的推移而发生退化,导致其化学性能、物理性能或预期功能的改变,进而影响医疗器械整体性能。如某些高分子材料和组合产品中的药物、生物活性因子等。
2. 医疗器械中各原材料/组件之间可能发生的相互作用。
3. 医疗器械中各原材料/组件与包装材料(包括保存介质,如角膜接触镜的保存液等)之间可能发生的相互作用。
4. 生产工艺对医疗器械中各原材料/组件、包装材料造成的影响,如生产过程中采用的灭菌工艺等。
5. 医疗器械中含有的放射性物质和其放射衰变后的副产物对医疗器械中原材料/组件、包装材料的影响。
6. 无菌包装产品中微生物屏障的保持能力。
内部因素和外部因素均可不同程度地影响医疗器械产品的技术性能指标,当超出允差后便可造成器械失效。由于影响因素很多,注册申请人不可能将全部影响医疗器械货架有效期的因素进行规避,但应尽可能将各因素进行有效控制,使其对医疗器械技术性能指标造成的影响降至最低。
需要强调的是,并不是所有的医疗器械均需要有一个确定的货架有效期。当某一医疗器械的原材料性能和包装材料性能随时间推移而不会发生显著性改变时,则可能没有必要确定一个严格的货架有效期,而当某一医疗器械的稳定性较差或临床使用风险过高时,其货架有效期则需要进行严格的验证。对于以无菌状态供应的无源植入性医疗器械,注册申请人应指定一个经过验证的确定的货架有效期。
(二)货架有效期验证过程
医疗器械货架有效期的验证贯穿该器械研发的整个过程,注册申请人应在医疗器械研发的最初阶段考虑其货架有效期,并在产品的验证和改进过程中不断进行确认。
首先,注册申请人要为医疗器械设定保证运输、储存和预期功效的货架有效期。
其次,注册申请人需对用于生产和包装医疗器械的材料、组件和相关生产工艺,以及涉及到的参考资料进行全面评估。如必要,还需进行实验室验证和调整生产工艺。
注册申请人根据评估结果设计医疗器械的货架有效期验证方案,并依据方案所获得的验证结果确定该医疗器械的货架有效期。如验证结果不能被注册申请人所接受,则需对其进行改进,并于改进后重新进行验证。
最后,注册申请人需要制定严格的质量体系文件以确保产品在货架有效期内进行储存、运输和销售。
注册申请人应认真保存医疗器械货架有效期验证过程中涉及的各种文件和试验数据,以便在申请注册时和对货架有效期进行重新评价时提供详细的支持性资料。
(三)货架有效期验证内容
1. 验证试验类型
医疗器械货架有效期的验证试验类型通常可分为加速稳定性试验和实时稳定性试验两类。
(1)加速稳定性试验
加速稳定性试验是指将某一产品放置在外部应力状态下,通过考察应力状态下的材料退化情况,利用已知的加速因子与退化速率关系,推断产品在正常储存条件下的材料退化情况的
试验。
加速稳定性试验设计是建立在假设材料变质所涉及的化学反应遵循阿列纽斯(Arrhenius)反应速率函数基础上的。该函数以碰撞理论为基础,确认化学反应产生变化的反应速率的增加或降低按照以下公式进行:
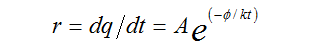
r:反应进行的速率;A:材料的常数(频率因子); :表观活化能(eV);k:波尔兹曼常数(0.8617×10-4eV/K);t:绝对温度。
大量化学反应的研究结果表明温度升高或降低10℃会导致化学反应速率增加一倍或减半。则可根据阿列纽斯反应速率函数建立加速老化简化公式:
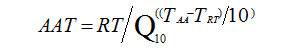
AAT:加速老化时间;RT:实时老化时间;Q10:温度升高或降低10℃的老化系数;TAA:加速老化温度;TRT:正常储存条件下温度。
上述公式反映了加速稳定性试验中加速老化时间与对应的货架有效期的关系。其中,Q10一般设定为2。当注册申请人对医疗器械和包装的材料的评估资料不齐备时,Q10可保守设定为1.8。如注册申请人在加速稳定性试验中设定的Q10大于2,则应同时提供详细的相关研究
资料。
此外,设定较高的加速老化温度可减少加速稳定性试验的时间。但是,由于较高的温度可能导致医疗器械原材料/组件和包装材料的性质发生改变或引发多级或多种化学反应,造成试验结果的偏差。因此,加速老化温度一般不应超过60℃。如注册申请人在加速稳定性试验中设定了更高的加速老化温度,亦应提供详细的相关研究资料。
需要说明的是,当医疗器械的原材料/组件在高温状态下易发生退化和损坏时,则不应采用加速稳定性试验验证其货架有效期。
(2)实时稳定性试验
实时稳定性试验是指将某一产品在预定的储存条件下放置,直至监测到其性能指标不能符合规定要求为止。
实时稳定性试验中,注册申请人应根据产品的实际生产、运输和储存情况确定适当的温度、湿度、光照等条件,在设定的时间间隔内对产品进行检测。由于中国大部分地区为亚热带气候,推荐验证试验中设定的温度、湿度条件为:25℃±2℃,60%RH±10%RH。
无源植入性医疗器械的实时稳定性试验和加速稳定性试验应同时进行。实时稳定性试验结果是验证产品货架有效期的直接证据。当加速稳定性试验结果与其不一致时,应以实时稳定性试验结果为准。
2. 验证试验检测/评价项目
无论加速稳定性试验还是实时稳定性试验,注册申请人均需在试验方案中设定检测项目、检测方法及判定标准。检测项目包括产品自身性能检测和包装系统性能检测两方面。前者需选择与医疗器械货架有效期密切相关的物理、化学检测项目,涉及产品生物相容性可能发生改变的医疗器械,需进行生物学评价。如适用,可采用包装封口完整性检测用于替代无菌检测。后者则包括包装完整性、包装强度和微生物屏障性能等检测项目。其中,包装完整性检测项目包括染色液穿透法测定透气包装的密封泄漏试验、目力检测和气泡法测定软性包装泄漏试验等;包装强度测试项目包括软性屏障材料密封强度试验、无约束包装抗内压破坏试验和模拟运输试验等。
建议注册申请人在试验过程中设立多个检测时间点(一般不少于3个)对无源植入性医疗器械进行检测。可采用零点时间性能数据作为检测项目的参照指标。
3. 进行验证试验的产品
医疗器械货架有效期验证试验应采用与常规生产相同的终产品进行。验证的医疗器械建议至少包括三个代表性批次的产品,推荐采用连续三批。注册申请人可对试验产品进行设计最差条件下的验证试验以保证试验产品可代表最恶劣的生产情况,如进行一个标准的灭菌周期后,附加一个或多个灭菌周期,或采用几种不同的灭菌方法。
4. 验证试验中采用的统计处理方法
注册申请人应在验证试验方案中设定每一检测项目的检测样品数量以确保检测结果具有统计学意义,并在试验报告中提供相关信息。
(四)参考标准
建议医疗器械注册申请人尽可能采用国家标准、行业标准和公认的国际标准中规定的方法/措施对其医疗器械产品货架有效期进行验证,以减少验证结果的偏差,提高验证结论的准确性。附录中列举了可能在货架有效期验证过程中涉及的部分标准,但不仅限于所列内容。
(五)注册时应提交的技术文件
注册申请人在无源植入性医疗器械注册时需提供详细的货架有效期验证资料,一般包括以下内容:
1. 与申请注册产品货架有效期相关的基本信息。包括该医疗器械原材料/组件、包装材料、生产工艺、灭菌方法(如涉及)、货架有效期、储存运输条件等;
2.注册申请人在该医疗器械货架有效期验证过程中对相关影响因素的评估报告;
3. 实时稳定性试验的试验方案及试验报告,同时提供试验方案中检测项目、检测判定标准、检测时间点及检测样本量的确定依据和相关研究资料;
4. 如适用,可提供加速稳定性试验的试验方案和试验报告,同时提供加速稳定性试验的试验方案中检测项目、检测判定标准、加速老化参数、检测时间点及检测样本量的确定依据和相关研究资料;
5. 包装工艺验证报告及包装、密封设备的详述;
6.注册申请人认为应在注册时提交的其他相关支持性资料。
注册申请人可在申请注册产品的货架有效期技术文件中使用其生产的其他医疗器械产品的货架有效期研究资料及验证资料,但应同时提供二者在原材料、包装材料、生产工艺、灭菌方法(如涉及)等与货架有效期相关的信息对比资料和二者在货架有效期方面具有等同性的论证资料。
四、名词解释
货架有效期(Shelf Life):指医疗器械形成终产品后能够发挥拟定作用的时间段。货架有效期的终点是产品失效日期。超过此期限后,医疗器械产品将可能不再具有预期的性能参数及功能。
植入性医疗器械(Implantable Medical Device):指借助手术全部或者部分进入人体内或腔道(口)中,或者用于替代人体上皮表面或眼表面,并且在手术过程结束后留在人体内30日(含)以上或者被人体吸收的医疗器械。(该定义不适用于有源植入性医疗器械)
五、参考文献
1. Clark GS, Shelf Life of Medical Devices, FDA, April 1991
2. Container and Closure System Integrity Testing in Lieu of Sterility Testing as a Component of the Stability Protocol for Sterile Products, FDA, February 2008
3. Guidance Technical Files and Design Dossiers for Non Active Medical Devices, TDesign Dossiers forn Lieu of Sterility
4. 《化学药物稳定性研究技术指导原则》(2005.3)
5. 王春仁,许伟,医疗器械加速老化实验确定有效期的基本原理和方法,《中国医疗器械信息》2008年第14卷第5期
六、起草单位
国家食品药品监督管理总局医疗器械技术审评中心
附录:货架有效期验证过程中涉及的部分标准
附录
货架有效期验证过程中涉及的部分标准
一、基本要求和质量体系标准
1.ISO 11607-1 《最终灭菌医疗器械的包装第1部分:材料、无菌屏障系统和包装系统
要求》
2.ISO 11607-2 《最终灭菌医疗器械的包装第2部分成形、密封和装配过程的确认要求》
二、包装系统试验方法标准
1.YY/T 0681.1《无菌医疗器械包装试验方法第1部分:加速老化试验指南》
2.YY/T 0681.2《无菌医疗器械包装试验方法第2部分:软性屏障材料的密封强度》
3.YY/T 0681.3《无菌医疗器械包装试验方法第3部分:无约束包装抗内压破坏》
4.YY/T 0681.4《无菌医疗器械包装试验方法第4部分:染色液穿透法测定透气包装的密封泄漏》
5.YY/T 0681.5《无菌医疗器械包装试验方法第5部分:内压法检测粗大泄漏(气
泡法)》
6.ASTM D 4169 《运输集装箱和系统性能测试》
7.ASTM F 1608 《透气包装材料阻微生物穿透等级试验》
三、包装材料标准
1.YY/T 0698.2《最终灭菌医疗器械包装材料第2部分:灭菌包裹材料要求和试验方法》
2.YY/T 0698.3《最终灭菌医疗器械包装材料第3部分:纸袋、组合袋和卷材生产用纸要求和试验方法》
3.YY/T 0698.4《最终灭菌医疗器械包装材料第4部分:纸袋要求和试验方法》
4.YY/T 0698.5《最终灭菌医疗器械包装材料第5部分:纸与塑料膜组合的热封和自封袋和卷材要求和试验方法》
5.YY/T 0698.6《最终灭菌医疗器械包装材料第6部分:用于低温灭菌过程或辐射灭菌的无菌屏障系统生产用纸要求和试验方法》
6.YY/T 0698.7《最终灭菌医疗器械包装材料第7部分:环氧乙烷或辐射灭菌的医用无菌屏障系统生产用可密封涂胶纸要求和试验方法》
7.YY/T 0698.8《最终灭菌医疗器械包装材料第8部分:蒸汽灭菌器用重复性使用灭菌容器要求和试验方法》
8.YY/T 0698.9《最终灭菌医疗器械包装材料第9部分:可密封组合袋、卷材和盖材生产用无涂胶聚烯烃非织造布材料要求和试验方法》
9.YY/T 0698.10《最终灭菌医疗器械包装材料第10部分:可密封组合袋、卷材和盖材生产用涂胶聚烯烃非织造布材料要求和试验方法》

欢迎关注《医疗装备》官方公众号