发布时间:2025-03-20 09:27:29 浏览 次
作者:杨晓娟,郭志武,马红丽,杨友锋,王浩,王奕江,李振勇(通信作者)
单位:苏州华益美生物科技有限公司 (苏州太仓 215400)
〔关键词〕KRAS;基因突变;性能评价;试剂盒
〔中图分类号〕R735.35 〔文献标识码〕B
〔文章编号〕1002-2376(2025)01-0027-05
RAS 基因家族包括 HRAS、KRAS 和 NRAS。研究报道显示,KRAS 基因在多种癌症中具有较高的突变率,尤其在结直肠癌中,KRAS 基因突变较为突出 [1-2]。结直肠癌是我国第三大常见癌症,发病率和病死率较高 [3-4]。根据 2020 年的统计数据,中国结直肠癌的发病率和病死率在全球范围内分别位居第 2 位和第 5 位 [5]。晚期结直肠癌患者的治疗方法选择有限,但靶向治疗药物如西妥昔单抗(Cetuximab)的出现为结肠癌的治疗提供了新的治疗方向。目前,《国家卫健委中国结直肠癌诊疗规范(2023 版》推荐对结直肠癌患者进行 KRAS基因突变检测,以指导个性化治疗 [6]。KRAS 基因突变的检测技术包括高通量测序、Sanger 测序、突变扩增系统聚合酶链式反应(amplification refractory mutation system, Polymerase Chain Reaction ARMS-PCR)、GOLD-PCR、数字 PCR 和高分辨率熔解曲线分析法 [7-12]。尽管测序技术在准确度方面具有一定优势,但灵敏度欠佳。数字 PCR 虽然灵敏度高,但成本较高。实时荧光 PCR 技术以其高灵敏度、良好的特异度、简便的操作和较低的成本已经广泛应用于各大医院[13]。近年来,随着个性化医疗技术的不断发展,KRAS 基因突变检测试剂盒的市场需求日益增长。
本研究依据国家药品监督管理局(Nationel Medical Products Administration,NMPA)发布的《肿瘤个体化治疗相关基因突变检测试剂技术审查指导原则》[14] (以下简称《指导原则》)对新开发的人KRAS 基因突变检测试剂盒(PCR- 荧光法)进行性能评价,旨在为结直肠癌患者的辅助诊断提供参考依据。
1 材料与方法
1.1 一般材料
KRAS 基因突变标准物质:KRAS 基因突变标准物质是从 KRAS 基因突变细胞系中提取、纯化的全基因组 DNA,KRAS(G12S)、KRAS(G12R)、KRAS(G12C)、KRAS(G12D)、KRAS(G12A)、KRAS(G12V),标准物质购买于中国计量科学研究院;KRAS(G13D)、KRAS 野生型基因组 DNA标准物质购买于南京科佰生物科技有限公司 。结直肠癌临床样本:选择首都医科大学附属北京世纪坛医院(伦理审批件:2019 伦审第 46 号)、河南省肿瘤医院(伦理审批件:2019313)、河北医科大学第四医院(伦理审批件:2019073)的共计 1 048 例结直肠癌石蜡切片临床样本作为临床比对研究对象。其中,男 555 例(52.96%)、女 493 例(47.04%) ;年龄 20 ~ 96 岁,平均(60.76±12.71)岁;肿瘤部位:结肠 315 例,直肠 190 例,结直肠 543 例;病理组织学分化:低分化 151 例,中分化 357 例,中高分化 31 例;组织学分级:结直肠腺癌Ⅱ级317 例,结直肠腺癌Ⅱ ~ Ⅲ级 36 例。
纳入标准:诊断为结直肠癌患者的检测剩余组织切片样本。排除标准:石蜡切片样本保存时间超过 2 年,病例资料不全。
1.2 仪器与试剂
苏州华益美生物科技有限公司开发的人 KRAS基因突变检测试剂盒(PCR- 荧光法)(以下简称考核试剂),已获得江苏省医疗器械检验所的注册检定报告,报告编号为 2019ZC 类第 0163 号。本研究共计使用 3 批考核试剂。选择经 NMPA 批准的 K-ras 基因突变检测试剂盒(PCR- 荧光探针法)(北京鑫诺美迪基因检测技术有限公司,国械注准 20143402142)(以下简称对照试剂)为临床对比研究试剂。 核酸提取仪 BACME SLA-D14800(苏州华益美生物科技有限公司),实时荧光定量 PCR 仪 7500(Thermo Fisher Scientific),移液器(DRAGONLAB)。
1.3 方法
根据 NMPA 发布的《指导原则》[14] 对考核试剂的准确度、特异度、检测限、精密度、一致性进行评估。
1.3.1 准确度
使用 5 ng/μl KRAS 野生型基因组 DNA 分别稀释 KRAS(G12S)、KRAS(G12R)、KRAS(G12C)、KRAS(G12D)、KRAS(G12A)、KRAS(G12V)、KRAS(G13D) 全基因组 DNA,使最终各反应体系中 KRAS(G12S)、KRAS(G12R)、KRAS(G12C)、KRAS(G12D)、KRAS(G12A)、KRAS(G12V)、KRAS(G13D)突变型含量均为 1%(样本编号为P1 ~ P7),采用考核试剂检测 P1 ~ P7 样本,检测结果应为突变阳性。
1.3.2 特异度
(1)交叉反应验证:使用 5 ng/μl KRAS 野生型基因组 DNA 稀释 KRAS(G12S)、KRAS(G12R)、KRAS(G12C)、KRAS(G12D)、KRAS(G12A)、KRAS(G12V)、KRAS(G13D)基因组 DNA,使最终各反应体系中突变型含量均为 10%(样本编号为 MN1 ~ MN7)。使用 3 批考核试剂对 5 ng/μl 的野生型基因组 DNA(NN1)和 MN1 ~ MN7 样本进行检测,检测结果应为各突变型间均无交叉干扰,野生型样本为阴性。(2)KRAS 同源基因及相关病原体检测:使用移液器将待验证的 HRAS、NRAS 基因及诺瓦克病毒、大肠杆菌等病原体加入5 ng/μl KRAS 野生型基因组 DNA 中(样本编号为N1 ~ N10),采用 3 批考核试剂对 N1 ~ N10 进行检测,结果应未检出突变。
1.3.3 检测限
检测限样本的配置:使用含有不同浓度的KRAS 野生型基因组 DNA(浓度为 20.00、2.50、0.50、0.10、0.05 ng/μl) 分 别稀释 KRAS 突变型基因组 DNA 至各突变型浓度为 10.0%、2.0%、1.0%、0.5%、0.1%。于扩增反应终体系特定核酸浓度下,突变百分率的最低检测限:采用 3 批考核试剂对检测限样本进行检测,采用 Probit 分析模型分析在扩增反应终体系特定核酸浓度下,突变百分率的 95%阳性检出率。 在特定突变百分率下,扩增反应终体系中核酸浓度的最低检测限:采用 3 批考核试剂对检测限样本进行检测,采用 Probit 分析模型分析在特定突变百分率下,扩增反应终体系中核酸浓度的 95% 阳性检出率。
1.3.4 精密度
使用 KRAS 野生型基因组 DNA 及 KRAS 突变型基因组 DNA 配置精密度样本,KJ1(5 ng/μl 总基因组 DNA,10% 突变率)、KJ2(5 ng/μl 总基因组DNA,1% 突变率)和 KJN(5 ng/μl KRAS 野生型基因组 DNA)。
使用 KJ1、KJ2、KJN 精密度样本对 3 批考核试剂进行为期 20 d 的检测。检测结果:KJN 精密度样本的阳性率应为 0%;KJ1 精密度样本的检测结果应全部为阳性,且各突变型 ∆Ct 变异系数(coefficient of variation,CV)应≤ 15%;KJ2 精密度样本的检测结果阳性率应为 100%。
1.3.5 一致性
使用考核试剂和对照试剂分别检测 1 048 例结直肠癌临床样本,采用交叉四格表计算考核试剂和对照试剂的阳性符合率、阴性符合率和总符合率,并对 2 种试剂的检测结果进行一致性分析。
1.4 统计学处理
使用 SPSS 22.0 软件对数据进行分析和处理,并应用 Kappa 检验比较 2 种试剂的检测一致性,Kappa ≥ 0.75 为具有较高一致性。
2 结果
2.1 准确度
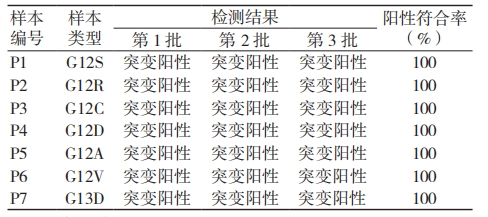
3 批考核试剂检测 P1 ~ P7 样本,检测结果均为相应突变型,测试阳性符合率为 100%,见表 1。
表 1 准确度检测结果统计
2.2 特异度
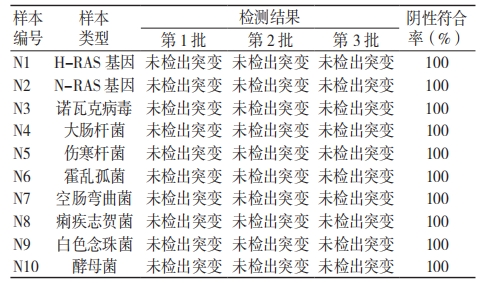
(1)考核试剂覆盖范围内的所有突变类型进行交叉反应验证:3 批考核试剂检测 NN1、MN1 ~MN7 样本 , 检测结果均显示各突变型间无交叉干扰,野生型样本检测结果也均为阴性,见表 2。(2)KRAS 同源基因及相关病原体检测:3 批考核试剂检测 N1 ~ N10 样本的结果显示,同源基因及相关病原体均未检出突变,测试阴性符合率为 100%,见表 3。
表 2 考核试剂覆盖范围内所有突变类型的交叉反应验证结果
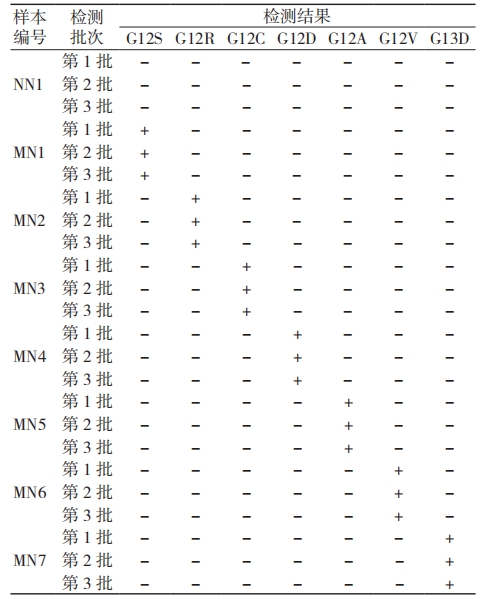
注:“+”表示检测结果为突变阳性,“-”表示检测结果为阴性,未检出突变
表 3 KRAS 同源基因及相关病原体特异度检测结果
2.3 检测限
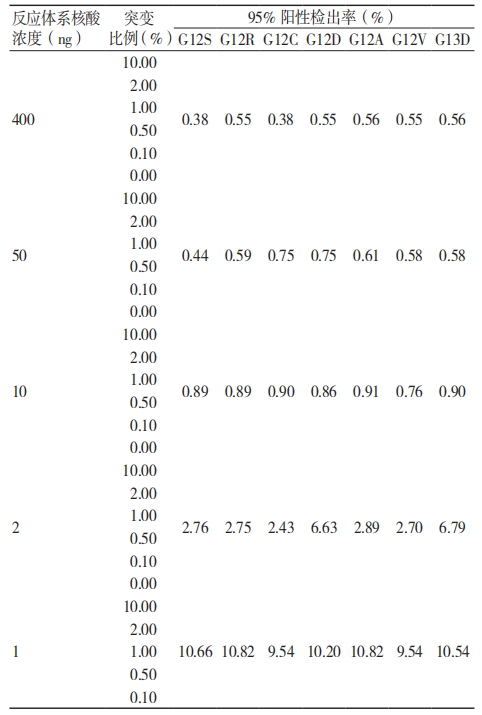
(1)于扩增反应体系特定核酸含量条件下,各 KRAS 突变型在 10 ng/ 反应体系的突变百分率的 95% 检出率均值均 ≤ 1%, 见表 4。(2) 于特定突变比例条件下,各 KRAS 突变型 1% 突变比例的反应终体系核酸浓度的 95% 检出率均值均≤ 10 ng/ 反应体系,见表 5。因此,将考核试剂的检测限确定为 10 ng 反应体系可检出 1% 的KRAS 突变型。
表 4 特定核酸浓度下突变比例的最低检测限
2.4 精密度
3 批考核试剂检测 KJN 精密度样本的阳性率均为 0%;KJ1 精密度样本的检测结果全部为阳性,且各突变型 ∆Ct 的 CV ≤ 15%;KJ2 精密度样本的检测结果阳性率均为 100%。精密度检测结果符合《指导原则》 的要求,考核试剂精密度良好。
表 5 特定突变比例下反应体系终核酸浓度的最低检测限

2.5 一致性分析
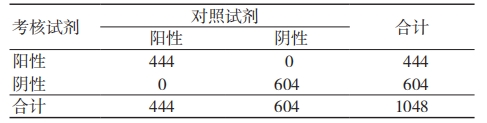
两组试剂的阳性和阴性结果对比见表 6。考核试剂与对照试剂的阳性符合率、阴性符合率、总符合率均为 100%。Kappa 一致性检验结果显示,Kappa ≥ 0.75,考核试剂与对照试剂的检测结果具有高度一致性。
表 6 考核试剂与对照试剂检测结果比较
3 讨论
KRAS 基因突变检测在结直肠癌患者的治疗中至关重要 [15],相较于 Sanger 测序法,实时荧光PCR 检测 KRAS 基因突变具有显著优势:灵敏度更高,能够精准捕捉低丰度的突变基因;操作流程简便快捷,可缩短检测周期;同时,检测成本更低,减轻患者经济负担。这些优势使其能够更高效地辅助结直肠癌症患者的临床治疗,为个性化精准医疗提供有力支持,有利于提升患者的治疗效果与预后。
本研究针对市场需求,基于多重 PCR、超敏检测特异引物及 TaqMan 荧光探针,构建安全高效的全自动核酸提取及扩增检测模式,本研究中的考核试剂不但可以提升检测效率,而且可以降低检测误差。反应体系中的外源性内参不但可以避免检测结果的假阴性,而且能全程监测样本提取及扩增,具有防污染作用的尿嘧啶 DNA 糖基化酶,可有效防止实验室扩增产物污染,避免样本假阳性扩增。
本研究对人 KRAS 基因突变检测试剂盒通过性能评价数据统计分析,试剂检测限为 10 ng/反应体系可检出 1% 的 KRAS 突变型、 精密度CV ≤ 15%,准确度检测均为突变阳性,特异度检测中 KRAS 基因突变检测试剂盒涵盖 7 个检测位点间均无交叉反应,同源基因及相关病原体检测均未检出突变型,性能评价指标符合《指导原则》[14] 的要求。临床对比研究中,考核试剂与对照试剂的阴性符合率、阳性符合率和总符合率均达 100%,且两者具有极高的一致性(Kappa ≥ 0.75)。
综上所述,本研究开发的人 KRAS 基因突变检测试剂盒(PCP- 荧光法)具有较高的准确度和可靠性,与已上市同类产品具有等效性,能够满足临床对 KRAS 基因突变检测的需求。
【参考文献】
[1]苟海梅,方莉,钟晓武 .KRAS、NRAS 及 BRAF 基因突变与结直肠癌肝转移的关系 [J]. 昆明医科大学学报,2023,44(1):19-24.
[2]靳杨,姜利琼,房烨,等 . 结直肠癌患者血清外泌体与组织中 KRAS,BRAF,NRAS 和 PIK3CA 基因突变检测及临床意义的比较 [J]. 现代检验医学杂志,2023,38(1):22-26.
[3]王锡山 . 中美结直肠癌流行病学特征对比及防控策略分析 [J]. 中华结直肠疾病电子杂志, 2019, 8(1):5.
[4]Baidoun F, Elshiwy K, Elkeraie Y, et al. Colorectal cancer epidemiology: Recent trends and impact on outcomes [J].Current Drug Targets, 2021, 22(9): 998-1009.
[5]Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries [J]. CA Cancer J Clin,2021,71(3):209-249.
[6]国家卫生健康委员会医政司,中华医学会肿瘤学分会 . 国家卫健委中国结直肠癌诊疗规范(2023版 )[J].中国实用外科杂志,2023,43(6):602-630.
[7]Wang H, Li H, Hu L, et al. EGFR and KRAS mutations in Chinese patients with sinonasal inverted papilloma and oncocytic papilloma[J]. Histopathology,2019, 75(2): 274-281.
[8]Dong L, Wang S, Fu B, et al. Evaluation of droplet digital PCR and next generation sequencing for characterizing DNA reference material for KRAS mutation detection [J].Scientific Reports, 2018, 8(1) :23.
[9]于丽华, 滕飞, 蒋明,等 . 一种检测 KRAS 基因突变的新型 TB-ARMS qPCR 方法的建立 [J]. 生物工程学报, 2019, 35(5):880-891.
[10]Freidin MB, Freydina DB. Circulating tumor DNA outperforms circulating tumor cells for KRAS mutation detection in thoracic malignancies [J]. Clin Chem, 2015, 61(10): 1299-1304.
[11]董莲华, 王晶, 傅博强,等 . 数字 PCR 和下一代测序方法用于 KRAS 基因突变检测中的可比性研究 [J]. 计量学报,2018,39(3):436-441.
[12]毛旭华, 汤俊明, 乔国洪,等 . 高分辨率熔解曲线技术检测结直肠癌患者 KRAS 基因突变 [J]. 中国肿瘤外科杂志,2017,9(5):296-299.
[13]Yang Q, Huo S, Sui Y, et al. Mutation status and immunohistochemical correlation of KRAS, NRAS, and BRAF in 260 Chinese Colorectal and gastric cancers[J]. Frontiers in Oncology, 2018, 8:487.
[14]国家食品药品监督管理总局 . 关于发布肿瘤个体化治疗相关基因突变检测试剂技术审查指导原则:2014 年第2 号 [EB/OL]. (2014-03-29). https://www.cmde.org.cn//flfg/zdyz/zdyzwbk/ 2017032911 3300693.html.
[15]Shen CJ, Chan RH, Lin BW, et al. Oleic acid-induced metastasis of KRAS/p53-mutant colorectal cancer relies on concurrent KRAS activation and IL-8 expression bypassing EGFR activation[J]. Theranostics, 2023, 13(13): 4650- 4666.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号