发布时间:2024-11-27 09:11:02 浏览 次
作者:朱超挺(通信作者),周天绮,胡彬
单位:浙江药科职业大学医疗器械学院 (浙江宁波 315100)
〔关键词〕增材制造;医疗器械;标准体系;审评指导原则;全生命周期质量控制
〔中图分类号〕R197.39 〔文献标识码〕A
〔文章编号〕1002-2376(2024)02-0160-05
基金项目:浙江省药品监督管理与产业发展研究会委托课题(ZYH2022009)
增材制造(additive manufacturing,AM)又名 3D 打印,于 1988 年由麻省理工 ElySachs 教授首次给 出命名,主要被用于满足模型制作和快速成型的高度专业化需求,现已成为计算机辅助设计(computer aided design,CAD)和快速制造的通用技术平台 [1]。 AM 技术以“逐层叠加”为核心思想,以三维模型 为样本,实现了从无到有的加工过程。与传统的减 材制造和模具注射成型技术相比,虽然 AM 技术在 加工速度和质量上存在缺陷,但其改变了传统的制造理念与方式,在制造领域拥有设计灵活性高、个性化成本低、原材料利用率高及工序少等独一无二 的优势。
AM 医疗器械是按仿生形态学、生物体功能及微环境等要求,用 AM 技术制造的模拟人体体内生物学结构和功能的医疗器械 [2]。AM 医疗器械呈现出多领域学科交叉的技术特点:覆盖从临床采集患者数据到制造、再到临床的过程,包括影像获取、产品设计、格式转换、材料控制、打印加工、后处理等环节,每个环节都对最终产品具有决定性影响 [3]。以上特点也对产品的全生命周期质量控制提出了严苛的监管要求。
随着 AM 技术在齿科和植入器械领域的快速发展,监管部门亟须制定更多的该领域国家标准与行业标准以响应市场需求。当前,AM 医疗器械标准体系及监管制度尚未建立完善,这必将对 AM 医疗器械的全生命周期质量控制提出挑战。因此,本研究对 AM 医疗器械行业发展现状进行综述,并提出了相关建设思路,以期系统化推进 AM 产业在医疗领域的高质量快速应用。
1 国内已取得 AM 医疗器械注册证现状
医疗器械按风险等级可划分为一类医疗器械(低风险)、二类医疗器械(中风险)和三类医疗器械(高风险)。截至 2023 年 7 月 23 日,国内已获批的 AM 医疗器械注册证共计 76 个,其中一类7 个(占比 9.21 %)、二类 55 个(占比 72.37 %,含 1 个进口许可产品)、三类 14 个(占比 18.42 %,含 2 个进口注册产品),见图 1。从图 1 可以发现,二类产品占据已注册产品的 50 % 以上,且三类产品占比远高于一类产品。这表明,目前 AM 医疗器械产品主要方向为二类和三类产品。图 2 为 2017 —2023 年注册及备案的 AM 医疗器械数量变化趋势。从图 2 可以发现,2017 — 2019 年,AM 医疗器械注册增速较为缓慢;从 2020 年开始 AM 医疗器械注册数量开始迅速增加,年增长率高达 60 % 以上,展示了这一领域的良好前景。
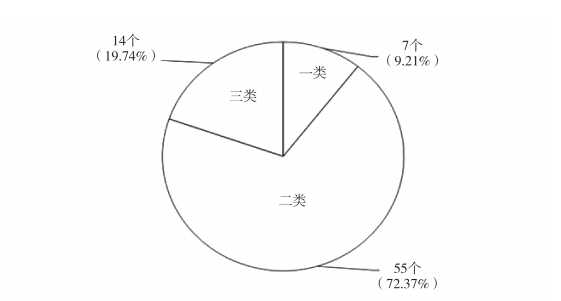
图 1 截至 2023 年 7 月 23 日国内累计获批的 AM 医疗器械数量
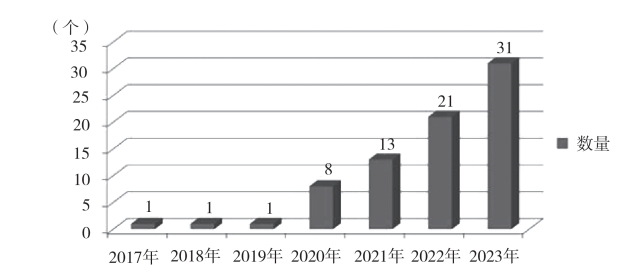
图 2 2017—2023 年的历年数量
图 3 为注册 AM 医疗器械产品的省份分布图。由图可知,重庆、北京和上海占据前 3 位,其数量总和接近所有已注册产品的 47.37 %。其中,三类产品主要分布在北京(8 个境内三类注册证)和上海(2 个进口三类注册证),分别占三类产品总数的 61.54 % 和 15.38%。
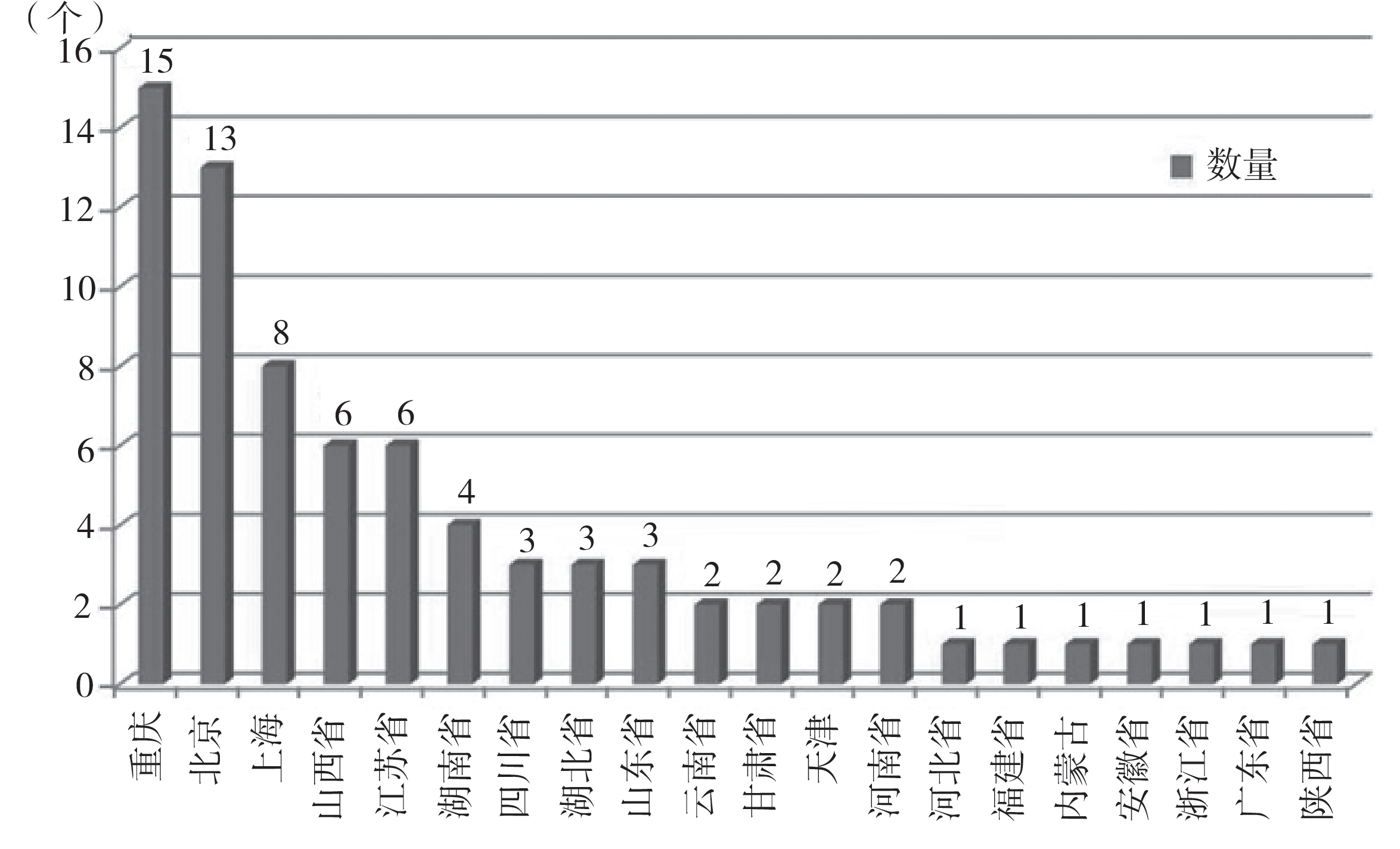
图 3 截至 2023 年 7 月 23 日国内累计获批的 AM 医疗器械省份分布情况
表 1 为截至 2023 年 7 月 23 日国内累计获批的部分 AM 医疗器械。由表可知,一类产品主要以工辅具、隔离眼罩和 AM 耗材为主,二类产品主要以手术导板和器官模型为主,三类产品以植入物为主。
表 1 截至 2023 年 7 月 23 日国内累计获批的部分AM 医疗器械


注:名称相似的产品仅保留第 1 次出现的注册证情况;数据来源:国家药品监督管理局
2 国内外标准化组织及 AM 标准现状
2.1 国外标准化组织及 AM 标准现状
针对 AM 的标准发布,国外以国际标准化组织TC 261 技术委员会(Technical Committee TC 261 of the International Organization for Standardization,ISO/TC 261)和美国材料与试验协会 F42 委员会(American Society for Testing and Materials F42 Committee,ASTM F42)为主要起草单位。两者联合制定了TC 261/184/156 等系列标准,为 AM 的标准化奠定了基础。其他组织包括美国国防部(United States Department of Defense,DOD)、美国联邦航空管理局(Federal Aviation Administration,FAA)、欧洲航空安全局(European Aviation Safety Agency,EASA)等。
目前,已有的国外 AM 标准包括 ISO-17296 系列标准、F42 系列标准及 ISO/ASTM 联合发布的系列标准。基本涵盖了术语、原材料、工艺、数据和试验方法等内容,以满足 AM 工业要求。
2.2 国内标准化组织及 AM 标准现状
2015 年 4 月,全国 AM 标准化技术委员会(SAC/TC 562)成立,负责 AM 术语和定义、工艺方法、测试方法、质量评价、软件系统及相关技术服务等领域国家标准的制修订工作 [4]。对口 ISO/TC 261,秘书处由中机生产力促进中心承担,由中国机械工业联合会负责日常管理和业务指导。目前,全国AM 标准化技术委员会的标准化活动主要围绕机械工业和航天领域,已组织制定 16 个国家标准,但是缺少医疗技术及产品相关标准。
2019 年 1 月 22 日,国家标准化管理委员会印发公告(2019 年第 2 号) [5],正式成立全国 AM 标准化技术委员会测试方法分技术委员会(SAC/TC 562/SC1),主要负责 AM 领域的专用材料、设备及成形件质量及安全测试方法等国家标准的制修订工作。
2019 年 11 月,中国食品药品检定研究院作为全国医用 AM 技术标准化技术归口单位获得国家药品监督管理局批准,开展对 AM 医疗器械产品质量控制技术的研究,推进国内医用 AM 技术标准化建设。截至 2023 年 7 月 23 日,国内已发布医用 AM国家标准及行业标准共计 5 项,见表 2。其中 3 项行业标准归口单位为中国食品药品检定研究院,分 别 为 YY/T 1701-2020、YY/T 1809-2021、YY/T 1851-2022。
表 2 截至 2023 年 7 月 23 日国内现行医用 AM 标准
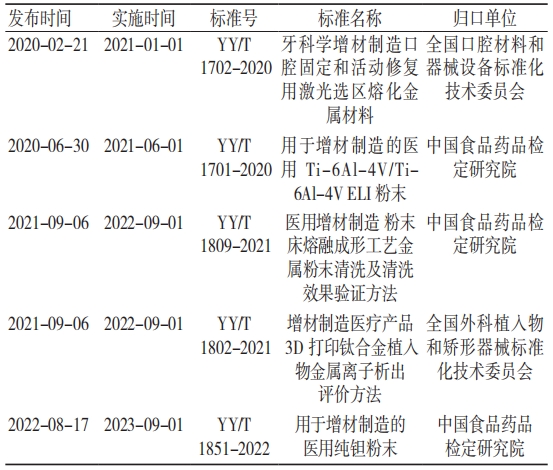
数据来源:全国标准信息公共服务平台
由于国家标准和行业标准更关注基础性、通用性、涉及安全性指标的标准研究,因此制定周期较长 [6]。而团体标准则具有快、新的特点。AM 领域的团体标准制定非常活跃(已发布 38 项团体标准),如中国医疗器械行业协会 3D 打印医疗器械专业委员会共发布团体标准 30 项,涵盖原材料、设备、软件、产品、方法、质量体系等,产品类别涉及骨科、口腔领域。目前已制定医用 AM 团体标准的单位包括中国医疗器械行业协会 3D 专委会、中国生物医学工程学会、中国生物材料学会等。
3 国内 AM 医疗器械的监管发展现状
2014 年,AM 骨科植入物被列入《需进行临床试验审批的第三类医疗器械目录》 [7]。2015 年,3D 打印手术导板或手术演练模型被定为二类医疗器械[8]。2018 年 2 月至今,定制式 AM 医疗器械相关注册技术审查指导原则开始制定。2019 年 7 月 4 日,中国《定制式医疗器械管理规定(试行)》 正式发布 [9]。
目前,国内已发布的 AM 医疗器械相关注册技术审查指导原则 5 项,正在征求意见的 4 项,涵盖了金属、高分子材料的骨科植入物及口腔相关器械。截至 2023 年 7 月 23 日已发布和正在征求意见的 AM 医疗器械相关指导原则见表 3。
表 3 截至 2023 年 7 月 23 日已发布和正在征求意见的 AM 医疗器械相关指导原则
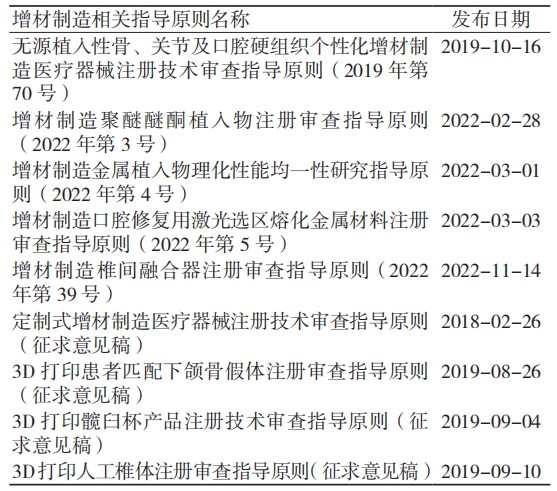
数据来源:国家药品监督管理局
4 国内 AM 医疗器械技术标准及监管体系建设路径思考
4.1 技术标准建设
基于已有的 AM 医疗器械技术标准体系,通过比对 AM 工业制造标准,筛选缺乏的医用标准体系。从基础标准、数据 / 软件、设备、材料、工艺 / 方法 5 个部分全方面比对国内外标准,梳理出工业化标准中适合医疗器械的部分标准,结合现有医疗标准和 AM 标准,形成标准体系间的无缝连接,见图 4。(1)完善医用 AM 原材料标准:普通工业 AM耗材与医用耗材标准有明显区别,结合已有的医用植入物耗材国家标准、行业标准,根据风险等级对工业化 AM 耗材中的性能指标重要性进行分类。(2)完善工艺验证方法标准:从加工工艺、专用力学性能测试方法、化学特性测试方法及生物学特殊风险评价方法 4 个角度对工艺验证方法标准进行分析,通过查找国内外文献等方式,提出具有针对性的建议,如加工工艺方面(提出稳定性方法标准和后处理工艺稳定性、有效性标准)、专用力学性能测试方法(提出专用测试方法、非破坏性测试方法等)。(3)完善专用设备标准:提出针对不同 AM 成型的工艺要求,建立专用于 AM 医疗器械打印设备的通用和专用要求,以及设备参数的验证方法。
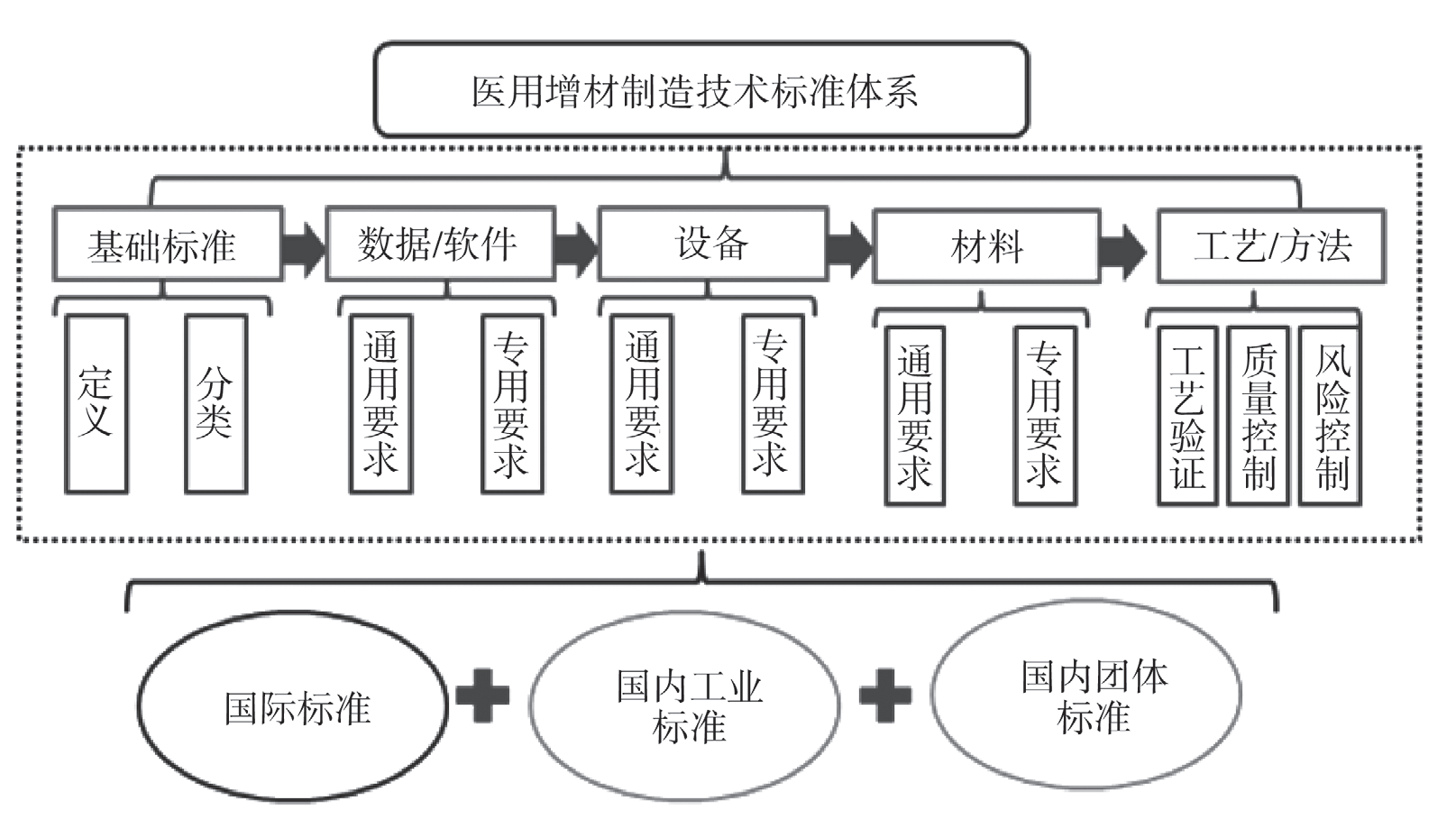
图 4 医用 AM 技术标准体系
4.2 监管体系建设
归纳总结 AM 医疗器械全生命周期的质量控制相关标准,提炼安全有效的质量控制要点。从产品设计、原材料控制、医工交互、数据建模、设备参数控制、打印后处理、成品质量控制、上市后使用的闭合生命周期,分析其中的质量控制要点。(1)产品设计的质量控制点包括原材料选择确认、打印模型获取途径确认、AM 设备确认。(2)原材料的质量控制点包括化学性能(粉末的化学组成)、物理性能(颗粒形状及结构、粒度分布、比表面积、颗粒密度等)、工艺性能(松装密度、振实密度、流动性等)。(3)医工交互的质量控制点包括匹配临床与定制需求、三维数据获取与确认。(4)数据建模的质量控制点包括数据传输确认、有限元分析确认。(5)设备参数的质量控制点包括 AM 设备运行确认、AM 工艺参数确认。(6)打印后处理的质量控制点包括表面硬度与粗糙度处理、残留粉末或支架去除确认、热应力消除及退火等力学性能补强方式。(7)成品质量的控制点包括物理化学性能评价、力学性能评价、生物相容性评价。(8)上市后使用的质量控制点包括不良事件监测。
5 小结
AM 医疗器械主要以二类和三类中高风险产品为主,且每年获批注册证的数量呈上升趋势。相比之下,国内现行 AM 医疗器械标准仅有 5 项,难以完全覆盖已注册和即将注册的产品。通过参考对比相关工业 AM 标准,结合医疗器械产品特点建立适用的 AM 医疗器械标准,以丰富现有的标准体系具有可行性。此外,AM 医疗器械产品相关的注册审查指导原则正在不断发布,全生命周期的质量控制仍是审查和监管的主要要点和方式。
【参考文献】
[1]宋波,张金良,章媛洁,等 . 金属激光增材制造材料设计研究进展 [J]. 金属学报,2023, 59(1):1-15.
[2]张永弟,王琮瑜,王琮玮,等 . 增材制造医用多孔钛合金研究与应用现状 [J]. 河北科技大学学报,2021,42(6): 601-612.
[3]韩倩倩,李茂,王春仁,等 . 医用增材制造医疗器械的质控重点与标准化工作进展 [J]. 组织工程与重建外科杂志,2018,14(3):121-122,135.
[4]彪伟 . 全国增材制造标准化技术委员会成立 [J]. 中国标准化,2016(5): 23.
[5]国家标准化管理委员会批准成立全国增材制造标准化技术委员会测试方法分技术委员会 [J]. 模具工业,2019,45(3):7-8.
[6]闻震 . 国家标准与行业标准 [J]. 石油工业技术监督,2006,22(12):60.
[7]张世庆,孙嘉怿,陈成,等 . 增材制造骨科植入型医疗器械的发展现状及应用 [J]. 生物骨科材料与临床研究,2018,15(1): 76-80.
[8]高志祥,龙能吉,张少云,等 . 髋关节翻修术应用3D 打印植入物的研究进展 [J]. 中华关节外科杂志(电子版),2019,13(6) :731-735.
[9]本刊讯 . 定制式医疗器械监督管理规定发布 [J]. 中国医疗器械杂志,2019,43(4) : 242.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号