发布时间:2024-07-01 09:45:03 浏览 次
作者:王蕊(第一作者),宋伟(第一作者),贺学英(通信作者),徐爽
单位:北京市医疗器械检验研究院(北京市医用生物防护装备检验研究中心) (北京 101111)
〔关键词〕细胞毒性试验;体外;MTT;法;浸提
〔中图分类号〕Q2-33 〔文献标识码〕B
〔文章编号〕1002-2376(2024)09-0041-04
体外细胞毒性试验是医疗器械生物学评价体系中的重要检测指标之一,其原理是运用细胞培养技术检测医疗器械和(或)浸提液对细胞正常功能和生物学行为的影响。体外细胞毒性试验因具有灵敏度高、操作简便、易标准化及重复性好的特点而被广泛应用。试验样品的采集和制备是得到准确、可靠试验结果的重要环节。目前,国内体外细胞毒性试验的样品制备依据现行标准体系下推荐的首选含血清培养液作为浸提介质在(37±1)℃条件下浸提(24±2)h。现行标准 GB/T 16886.5-2017《医疗器械生物学评价 第 5 部分:体外细胞毒性试验》[1](等同转化国际标准 ISO 10993-5:2009)及GB/T 16886.12-2017《医疗器械生物学评价 第 12 部分:样品制备与参照材料》[2](等同转化国际标准 ISO 10993-12:2012) 对 此 的 规 定 是 一 致 的。2021 年,国际标准化组织(International Organization for Standardization,ISO)认为浸提 24 h 获得的浸提物可能不足以代表医疗器械使用 24 h 后释放的化学物,因此发布新版标准 ISO 10993-12:2021[3]。ISO10993-12:2021 对于体外细胞毒性试验样品制备浸提条件的规定发生了变化,要求按照人体接触时间选择浸提条件,短期接触的医疗器械细胞毒性试验中的浸提条件可选择(37±1)℃浸提(24±2)h,而长期(> 24 h 至 30 d)或持久接触(>30 d)的医疗器械的浸提时间建议为 72 h。ISO 10993-12:2021 已转化为新版 GB/T 16886.12-2023《医疗器械生物学评价 第 12 部分:样品制备与参照材料》[4],于 2023 年11 月 27 日发布,2024 年 12 月 1 日开始实施。而GB/T 16886.5-2017[1] 中的规定短期内不变,2 个标准体系将平行实施。但 2 个标准体系对浸提条件的要求不一致,同一医疗器械产品选择不同的浸提条件进行体外细胞毒性试验,结果可能不一致,因此可增加评价风险。另外,含血清培养液在 37 ℃条件下孵育 72 h 是否会影响细胞的生长,目前尚无相关文献报道。基于此,本研究选取具有代表性的医疗器械常用材料进行体外细胞毒性试验,观察含血清培养液作为浸提介质在(37±1)℃条件下浸提 24、72 h 后对细胞生长与细胞毒性结果的影响,以寻找医疗器械产品评价风险点。
1 材料与方法
1.1 细胞系
小鼠成纤维细胞 L929(美国菌种保藏中心)。
1.2 试剂
MEM 细胞培养液(CORNING,规格:500 ml / 瓶),MTT(SIGMA-Aldrich 公 司, 规格:1 g / 瓶), 胎牛血清(天津康源生物技术有限公司, 规格:200 ml / 瓶);异丙醇(西陇化工股份有限公司,规格:500 ml / 瓶);二甲基亚砜(国药集团化学试剂有限公司,规格:500 ml / 瓶)。
1.3 仪器
台式恒温振荡器(苏州培英实验设备有限公司,型号:THZ-D)、酶标仪 [ 赛默飞世尔(上海)仪器有限公司,型号:Multiskan MK3]。
1.4 样品选择与制备
被检样品:选取 5 种医疗器械常用材料进行试验,具体信息见表 1。
表 1 5 种不同医疗器械常用材料

每种材料平行制备 2 份样品,其中 1 份置于(37±1)℃条件下浸提 24 h,另 1 份置于(37±1)℃条件下浸提 72 h,采用同步法进行试验。
对照样品:空白对照品为含血清的 MEM 细胞培养液,阴性对照品为 0.9% 氯化钠注射液,同样分成 2 份,置于(37±1)℃条件下分别浸提 24、72 h。阳性对照品为二甲基亚砜,无需浸提,直接使用。
1.5 试验方法
1.5.1 试验依据
采用 GB/T 16886.5-2017 推荐 MTT 法进行体外细胞毒性试验。
1.5.2 试验原理
通过代谢活性测定细胞的相对增殖率(relative growth rate,RGR),黄色水溶液 MTT 在活细胞内代谢性还原,生成蓝紫色不可溶的甲臜,活细胞的数目与甲臜溶于醇类后用光度计测定的色度相关。
1.5.3 试验分组
根据浸提时间不同,分为浸提 24 h 组和浸提72 h 组(以下简称 24 h 组和 72 h 组)。根据样品类型,24 h 组和 72 h 组包含空白对照组、阴性对照组和被检样品组。
1.5.4 试验步骤
将配制好的 1×105 /ml 细胞悬液接种于 96 孔培养板,设空白对照、阴性对照、阳性对照和被检样品组,每组各设至少 6 孔,每孔接种 100 µl 细胞悬液;置 5% CO2 培养箱 37 ℃条件下培养 24 h 后,弃净原培养液;空白对照组加入含血清 MEM 培养液,阴性对照组加入阴性对照品,阳性对照组加入 5%(体积分数)二甲基亚砜,被检样品组加入被检样品浸提液(分 100% 和 50% 浸提液两组进行),每孔 100 µl,置 CO2 培养箱继续培养 24 h;更换培养液后的 24 h,置显微镜下观察细胞形态;弃净孔内培养液,每孔加入 50 µl 1 g/L 的 MTT 溶液,继续培养 2 h 后弃净孔内液体,加入 100 µl 异丙醇,混匀后在酶标仪 570、650 nm 波长下测定吸光度,根据以下公式计算 RGR。
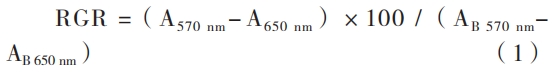
式中,RGR 为相对增殖率(单位:%),A 为供试品组(阴性、阳性组)的吸光度,AB 为空白对照组吸光度。
1.5.5 评价标准
细胞毒性结果按照表 2 进行判定。RGR 较低时,试验样品潜在的细胞毒性较高;RGR 降至 < 空白对照组的 70% 时,则具有潜在的细胞毒性。
表 2 细胞毒性分级

注:RGR 为相对增殖率;50% 浸提液孔平均值需高于100% 浸提液孔平均值,否则重新检测
2 结果
2.1 24 h 组和 72 h 组细胞生长状态比较
2.1.1 细胞形态学观察
空白对照组仅加入含血清 MEM 细胞培养液,细胞生长不受样品的影响。显微镜观察 24 h 组和72 h 组的空白对照组细胞生长情况,见图 1。两组细胞成梭形、三角形,细胞生长状态良好、贴壁伸展。

图 1 24 h 组和 72 h 组细胞生长状态显微镜观察图像
2.1.2 空白对照组的吸光度
吸光度可反映细胞增殖程度。同一试验体系中,吸光度越高,代表细胞增殖状态越好。计算24 h 组和 72 h 组中空白对照组的吸光度平均值及相对偏差,并对两组数据进行t检验。结果显示,24 h 组吸光度均值为 0.644,72 h 组吸光度均值为 0.625,相对偏差为 -3.0%,差异无统计学意义(P> 0.05),见表 3。
表 3 24 h 组和 72 h 组的空白对照组吸光度比较
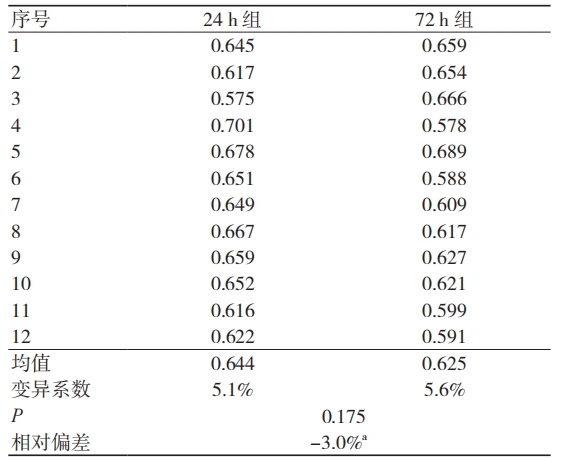
注:a 表示以浸提 24 h 下血清培养液吸光度为基准
2.2 24 h 组和 72 h 组被检样品组的 RGR 比较
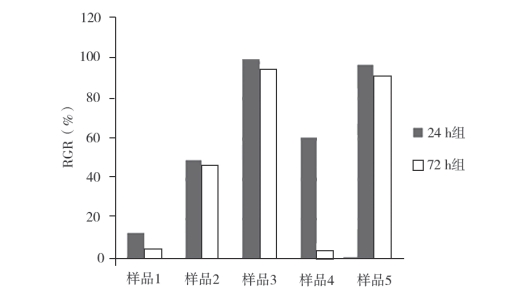
根据公式(1)计算 24 h 组和 72 h 组被检样品组的 RGR,比较两组间的相对偏差(以 24 h 组结果为基准),结果显示,样品 1、样品 2 和样品4 的 RGR < 70%,有细胞毒性,样品 3 和样品 5 的RGR ≥ 70%,无细胞毒性,浸提 24、72 h 的结果判定一致;所有样品的 RGR 均呈下降趋势,其中样品 4 的 RGR 降幅明显,为 93.7%,见表 4。
表 4 24 h 组和 72 h 组被检样品 RGR 的比较
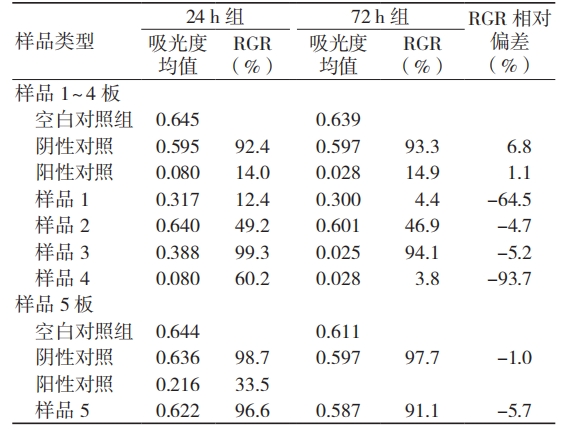
注:RGR 为相对增殖率
注:RGR 为相对增殖率
图 2 24 h 组和 72 h 组被检样品组 RGR 比较柱状图
3 讨论
本研究采用含血清 MEM 细胞培养液作为浸提介质,按照 GB/T 16886.12-2017 推荐的浸提比例,将空白对照品、阴性对照品及 5 种医疗器械常用材料在(37±1)℃条件下分别浸提 24、72 h,依据 GB/T 16886.5-2017 中的 MTT 法进行试验,通过测定吸光度,探讨浸提 24、72 h 对细胞生长及被检样品浸提液细胞毒性的影响。结果显示,含血清MEM 细胞培养液在 37 ℃条件下孵育 72 h 后培养细胞的吸光度低于孵育 24 h 的吸光度,但差异无统计学意义(P> 0.05),两组相对偏差仅 -3.0%;结合显微镜下观察细胞形态,24 h 组和 72 h 组细胞生长良好,可认为含血清培养基浸提 24、72 h 均对细胞生长无明显影响。
被检样品组中,24 h 组样品 1 和样品 2 的 RGR分别为 12.4% 和 49.2%,判定为有细胞毒性,评价结果明确,72 h 组样品 1 和样品 2 的 RGR 也均有下降,但与 24 h 组差别不大,两组评价结果一致;24 h 组样品 3 和样品 5 的 RGR 分别为 99.3%、96.6%,判定为无细胞毒性,72 h 组 RGR 轻度下降至 94.1%、91.1%,两组评价结果一致,且 RGR 变化不大;24 h 组样品 4 的 RGR 为 60.2%,处于判定标准临界值 70%附近,72 h 组样品 4 的 RGR 明显降低,仅 3.8%,显示细胞毒性明显增加,两组结果差异明显。
综上所述,对于 RGR>80% 的无细胞毒性产品及 RGR<60% 的有细胞毒性产品,浸提 24、72 h 不影响试验结果,评价风险较小;但对于 RGR 在60% ~ 80% 临界值的样品,不同浸提条件下的试验结果差异较大。因此,建议根据临床实际使用情况,尤其是长期接触人体的医疗器械产品进行体外细胞毒性试验时有必要浸提 72 h,以降低评价风险。
【参考文献】
[1]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会 . 医疗器械生物学评价 第5 部分:体外细胞毒性试验: GB/T 16886.5-2017[S]. 北京:中国标准出版社,2017.
[2]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会 . 医疗器械生物学评价 第12 部分:样品制备与参照材料:GB/T 16886.12-2017 [S]. 北京:中国标准出版社,2017.
[3]ISO. Biological evaluation of medical devices-Part 12: Sample preparation and reference materials: ISO 10993-12:2021(E) [S]. Geneva: International Organization for Standardization, 2021.
[4]国家市场监督管理总局,国家标准化管理委员会 . 医疗器械生物学评价 第12 部分:样品制备与参照材料:GB/T 16886.12-2023 [S]. 北京 : 中国标准出版社,2023.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号