发布时间:2023-10-16 09:32:55 浏览 次
作者:王亚萍,宋路萍,邢体坤,李静波,张静静(通信作者)
单位:目的 优化 HD-BioP3 细胞的电转染条件,提高 HD-BioP3 细胞的电转染效率。方法 使用电转染的方法将 GFP 质粒转入 HD-BioP3 细胞内,对电转染缓冲液、电转染温度和电转染质粒量 3 个因素进行优化,24 h 后通过全自动荧光细胞分析仪检测细胞活率及电转染效率。结果 3 个因素中,电转染缓冲液对电转染效率影响最大,其次为电转染质粒量,电转染温度影响最小。在 EX-CELL® CD CHO Fusion 作为电转染缓冲液、电转染温度为4 ℃、电转染质粒量为 30 μg 的条件下,电转染
〔关键词〕HD-BioP3;细胞;电转染;电转染效率;电转染缓冲液
〔中图分类号〕Q813.1 〔文献标识码〕B
〔文章编号〕1002-2376(2023)04-0008-04
基金项目:“重大新药创制” 科技重大专项(2018ZX09736010); 河南省重大科技专项(201110310100)
电转染主要通过物理电流击穿细胞膜形成瞬时孔隙,目的基因通过孔隙进入细胞 [1],这种方法具有操作简便、毒性小、电转染效率较高等优点,其转染效率通常在 30% ~ 90% 之间 [2-4]。电转染在克隆操作以及表达中具有重要作用,因此,提升基因电转染效率是当前基因工作研究人员关注的重点问题 [5]。电转染效率受很多因素的影响,包括电转染缓冲液 [6-8]、电转染程序 [9-11]、细胞数量 [12]、电转染质粒量 [13-15]、电转染前后温度 [16] 等。不同的细胞系有不同的最佳电转染条件 [17]。哺乳动物细胞的电转染通常在磷酸盐缓冲液(phosphate bufferedsaline,PBS)、PBS+ 蔗糖或培养基中进行 [18-19]。本研究分析电转染缓冲液、电转染温度和电转染质粒量 3 个因素对细胞活率及电转染效率的影响,从而确定 HD-BioP3 细胞的最佳电转染条件。
1 材料与仪器
1.1 材料
HD-BioP3 细胞购自 Horizon 公 司;GFP 质粒购自 Lonza 公司;EX-CELL® CD CHO Fusion 培养基、L-Glutamine solution、蔗糖购自默克公司;CD FortiCHOTM 培养基、PBS 购自赛默飞世尔科技公司;0.2% 台盼蓝溶液购自 Countstar 公司。
1.2 仪器
电穿孔系统( 品 牌:Bio-Rad 伯 乐, 型 号:Gene Pulser Xcell,用于转染每种细胞类型的模块化电穿孔系统);叠加式恒温振荡器(品牌:精骐,型号:IS-RDS6C,带 CO2);二氧化碳培养箱(品牌:Heal Force,型号:HF90);洁净工作台(品牌:苏净安泰,型号:SW-CJ-2FD);电热恒温水浴锅(品牌:上海一恒,型号:HWS-28);全自动荧 光 细 胞 分 析 仪( 品 牌:Countstar, 型 号:RigelS2);离心机(品牌:Eppendorf,型号:5804R)。
2 实验方法
2.1 HD-BioP3 细胞电转染优化前准备
37 ℃水浴复苏一支 HD-BioP3 细胞,待细胞生长至 1.5×106 ~4.0×106 cells/ml 时,按 0.2×106 cells/ml 接种至生长培养基(含 4 mmol/L L-Glutamine solution 的CD Forti CHOTM 培养基)中;电转染前一天将细胞以 0.5×106 cells/ml 接种至生长培养基中培养(培养条件:转速为 120 rpm,二氧化碳浓度为 5%,温度为 37 ℃,振幅为 26 mm),24 h 后用于电转染优化。
2.2 HD-BioP3 细胞电转染优化
2.2.1 HD-BioP3细胞电转染缓冲液和电转染温度优化
准备 PBS、PBS+5% 蔗糖、EX-CELL® CD CHOFusion 培养基、CD Forti CHOTM 培养基 4 种介质作为电转染缓冲液并分别标记为 Buffer1 ~Buffer4 备用; 取 2.1 中 准 备 的 细 胞, 将 0.2% 台 盼 蓝 溶 液与细胞悬液按照 1‥1 比例混合,采用全自动荧光细胞分析仪对细胞进行计数;根据计数结果取5×106 个细胞,以 220 rcf 速度离心 5 min,弃上清液;取电转染缓冲液 600 μl 重悬细胞,再加入 20 μgGFP 质粒,轻轻吹打混匀细胞和质粒转入电击杯,按上述步骤,Buffer1 ~Buffer4 各做两组,一组于常温条件下进行电击,另一组于 4 ℃条件下放置 5 min 后进行电击。电击参数设置如下,电压为 300 V,电容为 950 μF,脉冲为指数衰减,将电击后的细胞迅速转至含预热后的 5 ml 生长培养基的 T25 方瓶中,温度为 37 ℃,二氧化碳浓度为 5%,湿化过夜培养。
2.2.2 HD-BioP3 细胞电转染质粒量优化
根据 2.2.1 选择合适的电转染缓冲液和电转染温度,在 10 ~ 100 μg 之间设置 10 个梯度的电转染质粒量进行最佳电转染质粒量的优化,电击参数设置如下,电压为 300 V,电容为 950 μF,脉冲为指数衰减,将电击后的细胞迅速转到含预热后的5 ml 生长培养基的 T25 方瓶中,温度为 37 ℃,二氧化碳浓度为 5%,湿化过夜培养。
2.3 分析方法
HD-BioP3 细胞电转染优化 24 h 后,用 0.2% 台盼蓝溶液与细胞悬液按照 1‥1 比例混合,采用全自动荧光细胞分析仪对细胞进行电转染效率检测及计数。
3 结果分析
3.1 HD-BioP3 细胞电转染缓冲液和电转染温度优化结果分析
电 转 染 效 率 检 测 结 果 显 示, 在 常 温 条 件 下Buffer1~Buffer4 的细胞电转染效率依次为 8.4%、18.8%、48.8%、22.4%,在 4 ℃条件下 Buffer1~Buffer4 的细胞电转染效率依次为 20.9%、25.2%、67.3%、15.7%;Buffer1 在常温和 4 ℃条件下的细胞电转染效率相差12.5%,依次类推,Buffer1 ~Buffer4 在常温和 4 ℃条件下的细胞电转染效率相差在 6.4%~18.5% 之间;在同一温度下,4 种电转缓冲液的电转染效率差距较大,在常温条件下,Buffer2 和 Buffer4 的细胞电转染效率相差 3.6%,而 Buffer3 和 Buffer1 的细胞电转染效率相差 40.4%,因此在常温条件下细胞电转染效率相差 3.6%~40.4%,依此类推,在 4 ℃条件下细胞电转染效率相差 4.3%~51.6%(图 1~4)。
HD-BioP3 细胞电转染优化 24 h 后,结果显示,在常温条件下,Buffer1 和 Buffer3 细胞活率均 >80%,Buffer4 细 胞 活 率 <60%( 图 3); 在 4 ℃ 条 件 下Buffer3 细胞活率 >80%,Buffer1 和 Buffer4 细胞活率 <60%(图 4)。

注:上图为白光 / 明场通道图像;下图为绿光 /PI 通道图像;顺序从左至右依次为电转缓冲液 Buffer1 ~Buffer4
图1 在常温条件下 HD-BioP3细胞电转染24 h 后电转染效率
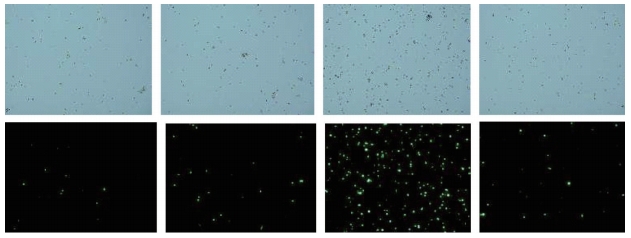
注:上图为白光 / 明场通道图像;下图为绿光 /PI 通道图像;顺序从左至右依次为电转缓冲液 Buffer1 ~Buffer4
图2 在4 ℃条件下 HD-BioP3细胞电转染24 h 后电转染效率
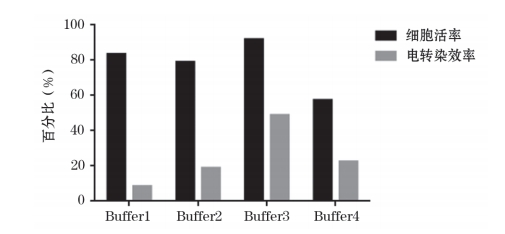
图3 常温条件下 HD-BioP3细胞在电转缓冲液Buffer1 ~Buffer4中细胞活率和电转染效率
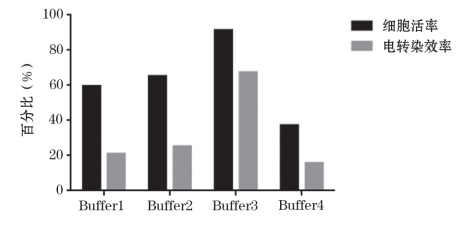
图4 在4 ℃条件下 HD-BioP3细胞在电转缓冲液Buffer1 ~Buffer4中细胞活率和电转染效率
3.2 HD-BioP3 细胞电转染质粒量测试
根据 3.1 选择细胞转染效率和细胞活率均最高的实验条件,即选择 Buffer3 作为电转染缓冲液在 4 ℃条件下进行电转染质粒量优化,结果显示,随着电转染质粒量的增加,细胞活率呈逐渐下降,10~30 μg 电转染质粒量细胞活率 >70%,40~70 μg 电转染质粒量细胞活率在 60%~65% 之间,80~100 μg 电转染质粒量细胞活率均 < 50%。随着电转染质粒量的增加,电转染效率逐渐升高;电转染质粒量为30 μg 时电转染效率达到平台期,电转染质粒量 >70 μg 时电转染效率出现下降趋势,电转染质粒量不同造成电转染效率最大相差 24.6%(图 5~7)。
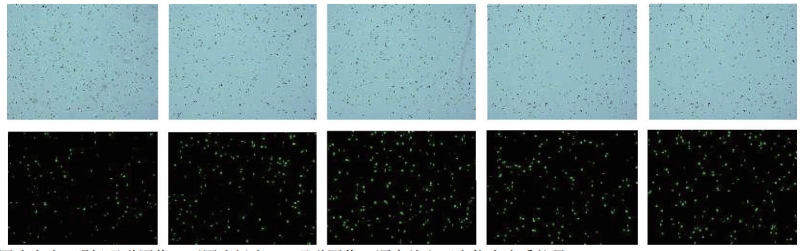
注:上图为白光 / 明场通道图像;下图为绿光 / PI 通道图像;顺序从左至右依次为质粒量 10 ~ 50 μg
图5 HD-BioP3细胞电转染24 h 后电转染效率
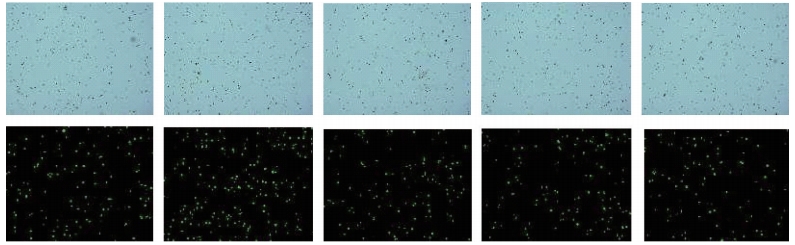
注:上图为白光 / 明场通道图像;下图为绿光 / PI 通道图像;顺序从左至右依次为质粒量 60~100 μg
图6 HD-BioP3细胞电转染24 h 后电转染效率
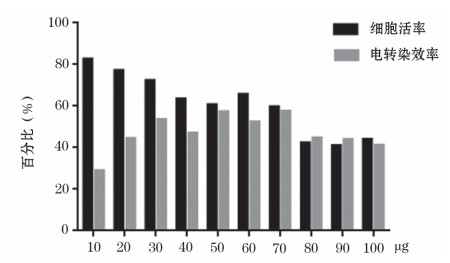
图7 HD-BioP3细胞不同电转染质粒量细胞活率和电转染效率
4 讨论
电转染是一种常用的细胞转染方法 [20],目的基因能否进行表达,取决于表达目的基因能否成功进入细胞 [21];这种电转染方式虽然操作简单,电转染效率高,但不合适的电转染条件容易导致细胞无法形成电穿孔或死亡,造成电转染效率下降 [22]。
本研究结果显示,在测试 3 个因素对电转效率的影响实验中,不同电转染缓冲液对电转染效率影响最大相差 51.6%,其次为不同电转染质粒量,电转质粒量对电转染效率影响最大相差 24.6%,电转染温度影响较小,不同电转染温度对电转染效率影响最大相差 18.5%。故在 EX-CELL® CD CHOFusion 作为电转染缓冲液、电转染温度为 4 ℃、电转染质粒量为 30 μg 的条件下,电转染效果最好。
综上所述,优化 HD-BioP3 细胞的电转染条件,可为研究外源基因电转染 HD-BioP3 细胞提供基础数据。
【参考文献】
[1]廖维芳,李建玲,孙芳,等 . 优化脂质体对肝癌细胞株 HepG2 细胞转染效率 [J]. 基因组学与应用生物学,2016,35(9):2229-2234.
[2]Nakayama A, Sato M, Shinohara M, et al. Efficient trans fection of primarily cultured porcine embryonic fibro blasts using the Amaxa Nucleofection System™[J]. Cloning Stem Cells, 2007, 9(4): 523–534.
[3]Richter A, Kurome M, Kessler B, et al. Potentialof primary kidney cells for somatic cell nuclear transfer mediated transgenesis in pig[J]. BMC Biotechnol, 2012(12): 84.
[4]Lu FH, Luo LC, Li N, et al. Efficient Generation of Transgenic Buffalos (Bubalus bubalis) by Nuclear Transfer of Fetal Fibroblasts Expressing Enhanced Green Fluorescent Protein[J]. Sci Rep, 2018, 8(1): 6967.
[5]Skołucka N, Saczko J, Kotulska M, et al. Electroporation and its application[J]. Pol Merkur Lekarski, 2010,28(168): 501-504.
[6]Sherba JJ, Hogquist S, Lin H, et al. The effects of electroporation buffer composition on cell viability and electrotransfection efficiency[J]. Sci Rep, 2020, 10(1): 3053.
[7]Eghbalsaied S, Hyder I, Kues WA. A versatile bulk electrotransfection protocol for murine embryonic fibroblasts and iPS cells[J]. Sci Rep, 2020, 10(1): 13332.
[8]Canoy RJ, André F, Shmakova A, et al. Easy and robust electrotransfection protocol for efficient ectopic gene expression and genome editing in human B cells[D]. England: Gene Ther, 2020.
[9]杨欢,李婷婷,彭腊如,等 . 水牛精原干细胞电转染条件的优化 [J]. 基因组学与应用生物学,2021,40(Z2):2455-2460.
[10]钟翠丽,李国玲,莫健新,等 . 不同电转仪的电转参数、质粒用量和拓扑结构对猪胎儿成纤维细胞转染效率的影响 [J]. 遗传,2017,39(10):930-938.
[11]Potter H, Heller R. Transfection by Electroporation[J]. Curr Protoc Mol Biol, 2018(121): 9.3.1-9.3.13.
[12]邓晓芬,杨晓佳,易天红,等 . 融合蛋白基因与抗体基因电转染 CHO-S 细胞的条件摸索优化 [J]. 生物技术通报,2019,35(4):223-228.
[13]杜靖,贝祝春,王红,等 . 伯氏疟原虫电穿孔转染方案的优化 [J]. 军事医学,2019,42(12):949-953.
[14]Potočnik T, Miklavčič D, Maček Lebar A. Gene transfer by electroporation with high frequency bipolar pulses in vitro[J]. Bioelectrochemistry, 2021(140): 107803.
[15]Zhang Z, Qiu SF, Zhang XP,et al. Optimized DNA electroporation for primary human T cell engineering[J].BMC Biotechnol, 2018, 18(1): 4.
[16]Fesmire CC, Petrella RA, Fogle CA,et al. Temperature Dep endence of H ig h Fre q uency I r rever sible Electroporation Evaluated in a 3D Tumor Model[J]. Ann Biomed Eng, 2020, 48(8): 2233-2246.
[17]李计来,崔文禹,刘敬,等 . CHO DG44 细胞电转染条件的优化 [J]. 中国生物制品学杂志,2017,30(11):1207-1210.
[18]Kumar P, Nagarajan A, Uchil PD. Electroporation[J]. Cold Spring Harb Protoc, 2019, 2019(7): 519-525.
[19]Kumar P, Nagarajan A, Uchil PD. DNA Transfection by Electroporation[J]. Cold Spring Harb Protoc, 2019, 2019(7): 559-563.
[20]陈凤,石德顺,黄贵婷,等 . 电穿孔法转染水牛脂肪干细胞与成纤维细胞的研究 [J]. 中国畜牧杂志,2016,52(11):60-65.
[21]张刻佩,王小平,朱武洋 . 外源基因转染细胞术的研究进展 [J]. 国际病毒学杂志,2016,23(3):212-214.
[22]Jordanet ET, Collns M, Terefe J, et al. Optimizing electroporation conditions in prinary and other difficult to transfectcells[J]. J Biomol Tech, 2008, 19(5): 328-334.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号