本指导原则旨在为技术审评部门审评注册申报资料提供参考,同时也指导注册申请人对第二类硬性光学内窥镜注册申报资料的准备及撰写。
本指导原则是对第二类硬性光学内窥镜的一般要求,审评人员和申请人应依据产品的具体特性确定其中内容是否适用,若不适用,需申请人具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。第二类硬性电子内窥镜和硬性纤维内窥镜可参考本指导原则中适用的内容。
本指导原则是供审评人员和申请人使用的指导文件,不涉及注册审批等行政事项,亦不作为法规强制执行,如有能够满足法规要求的其他方法,也可以采用,但应提供详细的研究资料和验证资料,应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规、标准体系及当前认知水平下制定的,随着法规、标准体系的不断完善和科学技术的不断发展,本指导原则相关内容也将适时进行调整。
一、适用范围
本指导原则适用于第二类观察用硬性光学内窥镜产品,即喉镜、鼻窦镜、尿道膀胱镜、宫腔镜、直肠镜。其他第二类硬性光学内窥镜可参考本指导原则适用的内容。
二、技术审查要点
(一)产品名称要求
1.喉镜或喉内窥镜;
2.鼻窦镜或鼻窦内窥镜;
3.尿道膀胱镜、膀胱镜、尿道膀胱内窥镜、膀胱内窥镜;
4.宫腔镜或宫腔内窥镜;
5.直肠镜或直肠内窥镜。
(二)产品的结构和组成
典型产品结构示意图如下:
1.喉镜

图 1 喉镜(可调焦)
1.镜体 2.目端接管(可调焦) 3.目镜罩 4.手柄 5.导光束接口

图 2 喉镜(不可调焦)
1.镜体 2.导光束接口 3.目镜罩
2.鼻窦镜

图 3 鼻窦镜
1.镜体 2.导光束接口 3.目端接管 4.目镜罩 5.尿道膀胱镜
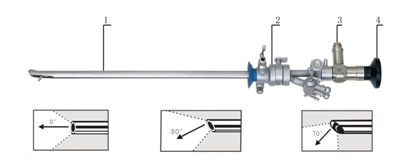
图 4 尿道膀胱镜
1.镜体 2.鞘套 3.导光束接口 4.目镜罩
4.宫腔镜

图 5 0°一体式宫腔镜
1.宫颈塞 2.镜体 3.器械孔道 4.目端接管 5.限位器
6.导光束接口 7.注液孔道 8.目镜罩

图 6 22°一体式宫腔镜
1.22°弯角 2.宫颈塞 3.镜体 4.器械孔道 5.目端接管
6.限位器 7.导光束接口 8.注液孔道 9.目镜罩
分体式宫腔镜一般由30°宫腔镜(图7所示)、操作器(图8所示)、鞘套(图9所示)等几部分组成。

图 7 30°宫腔镜

图 8 操作器

图 9 鞘套
5.直肠镜

图 10 直肠镜
1.闭孔器 2.窥视管 3.注气孔 4.手柄 5.导光束接口
6.器械孔道 7.目镜罩
(三)产品工作原理
1.产品的基本原理和实际使用描述
1.1 硬性光学内窥镜主要由光学成像系统和照明系统组成。
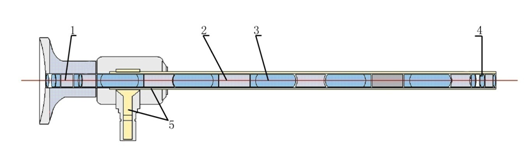
图 11 内窥镜产品内部结构示意图(1)
1.目镜罩 2.目镜 3.入光口 4.照明光纤 5.传像系统
6.转向棱镜 7.目镜保护片 8.视场光阑 9.外镜管 10.内镜管
11.物镜组 12.物镜组 13.保护片

图 12 内窥镜产品内部结构示意图(2)
1.目镜 2.间隔管 3.棒状镜 4.物镜 5.照明光纤
完整的光学成像系统由物镜系统、传像系统和/或目镜系统三大系统组成。工作原理:被观察物经物镜所成的倒像,通过传像系统将倒像以正像形式传输到目镜,再由目镜放大后,为人眼所观察。为构成不同的视向角,需加入不同的棱镜。不同用途的内窥镜根据使用要求制作成不同的外形、外径、长度,以达到使用所需的要求。
照明传输系统由光导纤维组成。工作原理:将冷光源的光经过光导纤维传输到内窥镜前端,照亮被观察物。
1.2 第二类硬性光学内窥镜产品是利用人体自然腔道进入人体观察和诊察,不需切口或打孔穿刺进入人体。尿道膀胱镜 、宫腔镜和直肠镜可以利用镜体本身的器械通道(如一体式)或配合使用的附件通道(如分体式)进入活检钳、剪刀 、锯齿钳进行活检取样、切割等临床手术;单纯的内窥镜可做检查诊断用(如喉镜 、鼻窦镜等)。硬性光学内窥镜的目镜罩除便于人眼直接观察外,通过目镜罩标准尺寸的规定,可与摄像系统连接,通过监视屏显示图像。也存在着无目镜罩的内窥镜,此类内窥镜不能直接目视,必须与摄像系统连接,通过监视屏显示图像。
在操作尿道膀胱镜时,先将鞘套与闭孔器插入尿道及膀胱,退出闭孔器。将内窥镜与镜桥(观察用插管时用插管器)联接插入鞘套后锁紧,进水和出水管联接鞘套水阀上,导光束联接内窥镜上,打开光源及水阀即可进行手术,将异物钳、剪刀、锯齿钳等插入器械通道可进行活检、取样等。
在操作宫腔镜时,先膨胀宫腔,然后将操作鞘套与闭孔器顺宫腔方向插入到宫颈内口稍下方,退出闭孔器,将操作器及内窥镜插入鞘套后锁紧,将输液管联接鞘套水阀上,在80—180mmHg范围的压力下注入5%葡萄糖或0.9%的生理盐水或甘露醇液体以膨宫。待排水孔流出的液体清亮后,在直视下将镜体进一步推进,待宫腔镜充分扩张后即可进行观察子宫异常或病变,若必要时可做相应的内膜活检、输卵管插管注药、分离粘连等手术。
直肠镜可在内窥镜直视下活检取样、切割。
(四)注册单元划分的原则和实例
按照 《 医疗器械注册管理办法 》 (国家食品药品监督管理总局令第4号) 第七十四条要求,“ 医疗器械产品的注册单元原则上以产品的技术结构 、性能指标和预期用途为划分 依据 ”。
一般情况下,仅仅是长度、直径、视向角、视场角、工作通道其中的一个或几个参数有差异,可以作为同一个注册单元,若内窥镜之间的差异超出上述范畴,应考虑应划分为不同的注册单元。
1.内窥镜有源或无源手术器械应与内窥镜划分为不同的注册单元。
2.不同适用范围的内窥镜应划分为不同的注册单元,如喉镜、鼻窦镜、尿道膀胱镜,原理、结构基本无大变化,每种产品作为一个注册单元。
3.内窥镜与配合使用的设备(例如冷光源、摄像系统等)应划分为不同的注册单元。
4.荧光镜 、带有 PDD 的内窥镜以及与上述典型内窥镜光学设计不同的内窥镜 (如可变焦内窥镜 、短景深内窥镜和可变工作距内窥镜)等特殊内窥镜与普通内窥镜应划分为不同的注册单元。
5.成像方式不同的内窥镜应划分为不同的注册单元。例如硬性光学镜与硬性纤维镜、硬性光学镜与硬性电子镜应划分为不同的注册单元。
6.对直肠镜,是否有光学系统可作为注册单元划分的依据。一种产品只是含有导光束、窥视管等,可提供光学照明,没有光学系统,不存在视场角、分辨率等的性能指标;另外一种产品既含有光导束,提供光学照明,又含有光学系统,提供观察和成像途径(详见典型产品结构示意图),这两种产品应作为两个注册单元。
7.宫腔镜分为一体式结构和分体式结构两种(详见典型产品结构示意图),但他们的原(机)理、结构、主要性能、预期目的基本相同,可作为同一注册单元的不同型号产品。
(五)产品适用的相关标准
1.适用的国家标准、行业标准
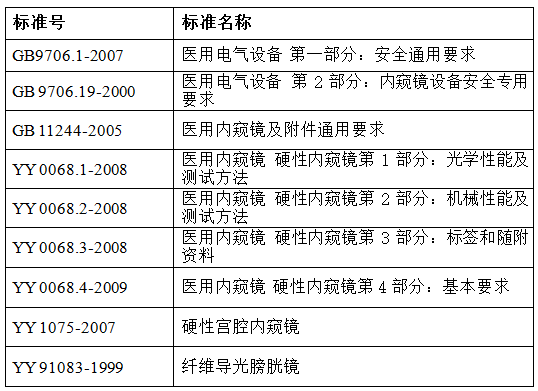
2.可引用或参照的国际标准:

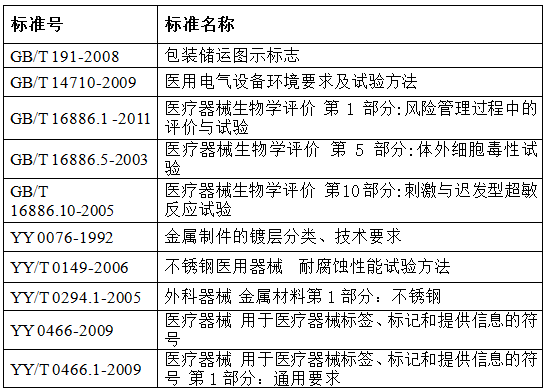
3.可引用或参照的其他相关标准:
(六)产品的适用范围、禁忌症
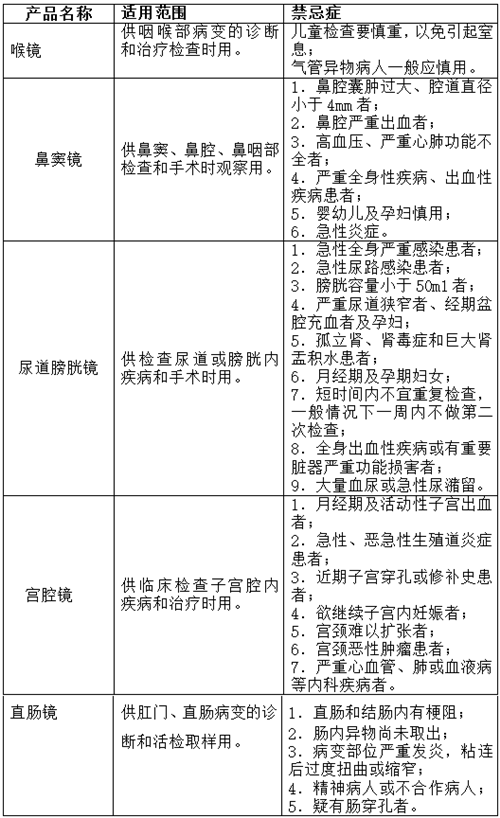
(七)产品的主要风险
1.能量危害
1.1 电能
1.1.1 可能的危害:
与冷光源、摄像显示系统等有源医疗器械互连使用时可能对使用者、患者产生电击危害。
1.1.2 可采取的风险控制措施:
—导光束两端之间采用绝缘隔离;和/或:在配合使用的冷光源光输出口与导光束之间采用绝缘隔离,确保互连后硬性光学内窥镜成为冷光源的BF型应用部分;
—与CCD摄像头相配接的目镜罩采用合适的绝缘材料制造;和/或:CCD摄像头物镜适配器采用合适的绝缘材料制造;和/或:采用接口用合适绝缘材料制造的CCD摄像头,使配合后硬性光学内窥镜成为摄像显示系统的BF型应用部分;
—使用说明书对与有源器械互连条件关于防止电击危害作详细说明。
1.1.3 审查要点:
—关注硬性光学内窥镜相关电气隔离部位的绝缘结构,如与CCD摄像头相配接的目镜罩、冷光源接口、导光束等相关附件的绝缘结构和材料等;
—审查产品技术要求中对相关安全条款的描述 ,如上述绝缘部位的电介质强度试验要 求等;
—审查注册检验报告中对相关安全要求的检验结果;
—审查随附文件(使用说明书等),随附文件中应有与有源器械互连条件关于防止电击危害的详细说明,至少应说明互连使用时,硬性光学内窥镜(及其附件)应成为该有源器械与硬性光学内窥镜组成的医用电气设备(系统)的BF/CF型应用部分;
1.2 热能
1.2.1 可能的危害:
与冷光源等有源医疗器械互连使用时可能超温,对患者产生灼伤危害。
1.2.2 可采取的风险控制措施:
—在冷光源灯座反光镜上镀红外增透膜、在光输出口设置红外滤光片,最大限度地限制红外光的输出;
—在相关部位采用绝热结构和材料;
—增加照明光路光纤密度,并提高界面抛光质量,减少光纤断丝;
—提高观察系统的镀膜质量,尽可能降低物面照度;
—使用说明书对与有源器械互联条件关于防止超温危害作详细说明。
1.2.3 审查要点:
—关注硬性光学内窥镜相关绝热部位,如手握部分 、目镜和插入部分的绝热结构和材 料等;
—审查随附文件(使用说明书等),随附文件中必须有与有源器械(如冷光源)互连条件关于防止超温危害的详细说明,如对冷光源的光谱性能做出规定等。
2.生物学危害
2.1 生物不相容性
2.1.1 可能的危害:
如果制造硬性光学内窥镜插入部分的材料不符合生物相容性要求,就可能对患者产生细胞毒性、致敏、刺激等危害。
2.1.2 可采取的风险控制措施:
与患者人体接触的部件,采用无毒、无致敏、无刺激的材料制造,且所购物资均有质保书,并严格按检验规程进行进货检验;
2.1.3 审查要点
全面审查硬性光学内窥镜成品中与患者和使用者接触部分所用材料生物相容性评价材料的符合性。
2.2 交叉感染
2.2.1 可能的危害:
如果硬性光学内窥镜在使用前后,不按规范严格地清洗、消毒和灭菌,就可能对患者产生交叉感染的危害。
2.2.2 可采取的风险控制措施:
在使用前后,应进行严格的清洗 、消毒和灭菌,执行《内镜清洗消毒技术操作规范》。 例如:
—浸入2%戊二醛溶液中100min,然后再用35℃左右清水冲洗并擦干;
—推荐用134℃,0.2MPa高压蒸汽灭菌。
2.2.3 审查要点:
—审查使用说明书,其中必须有使用前后清洗、消毒和灭菌方法的内容。如:执行《内镜清洗消毒技术操作规范》等。
—审查使用说明书,应有使用前后不按规定进行清洗、消毒和灭菌,会导致交叉感染危险的警示性说明。
3.环境危害
储存或运行偏离预定的环境条件,意外的机械破坏。
3.1 可能的危害:
如果硬性光学内窥镜在没有按要求包装运输,或贮存环境不满足要求,或使用时发生摔打、跌落和碰撞,就会造成镜片损坏发霉发雾、光轴偏移、管身瘪陷、密封性能变差而引起图像不清等现象,可能对患者产生误诊等危害。
3.2 可采取的风险控制措施:
—硬性光学内窥镜应进行合理包装,如:先装入中性塑料袋,再装入内衬软性塑料的硬质手提箱,并使各件分隔固定,硬质手提箱外套塑料袋,再装入瓦楞纸箱内;
—硬性光学内窥镜应贮存在相对湿度不超过80%、干燥、通风、无腐蚀性气体、无阳光直射的清洁室内;
—硬性光学内窥镜应放在专用箱内,不可交叉重叠放置;
—硬性光学内窥镜在储运和使用过程中,应避免摔打、跌落和碰撞等。
以上各项,可在外部标记和随附文件加以说明和警示。
3.3 审查要点:
—审查产品技术要求中关于环境试验的规定;
—审查注册检验报告中环境试验的检验结果;
—审查产品内外包装上的有关产品储运防护的标志;
—审查说明书中有关储运 、贮存方法的规定和硬性光学内窥镜损坏不得使用的警示性 说明。
4.与硬性光学内窥镜使用有关的危害
4.1 不适当的标记
4.1.1 可能的危害:
硬性光学内窥镜的对镜桥、镜鞘、操作器的配合性要求较高,如配合件上没有适当的配套用标识,或实际值与标识值不符,导致配合不当,可能对患者产生损伤组织等危害。
4.1.2 可采取的风险控制措施:
—必要时硬性光学内窥镜上应有适当的配套用的标识;
—出厂时严格检查实际规格与标识值是否相符;
—使用前检查配套标识的一致性。
4.1.3 审查要点:
—审查注册申报资料中关于产品标识的规定;
—审查注册检验报告中对产品标识要求的检验结果;
—审查随附文件(使用说明书等)中有关产品标识的说明。
4.2 不适当的操作说明
4.2.1 可能的危害:
—使用前检查规范不适当,如未说明必须检查硬性光学内窥镜成像清晰度等性能、电气安全性是否良好,与导光束的配接及导光束与冷光源的配接是否良好等事项;
—硬性光学内窥镜和/或与之配合的器械使用操作说明不适当,就会由于设备共用不当而对患者产生危害;
—硬性光学内窥镜的维护规范不适当,如消毒灭菌方法不合适,导致硬性光学内窥镜性能变差、消毒灭菌不彻底,对患者产生误诊或交叉感染等危害。
4.2.2 可采取的风险控制措施:
—仔细编写操作说明,对硬性光学内窥镜配合器械的规范、使用前检查规范、使用后维护规范进行充分、必要、简洁的叙述。
—编写的操作说明,应由设计人员、临床医生等相关专家审定。
—使用前的检查可包括:硬性光学内窥镜成像清晰度等性能、电气安全性是否良好,是否有锐边、锐角。硬性光学内窥镜与导光束的配接、导光束与冷光源的配接是否好。冷光源的工作是否可靠,连接后要确认插入部位温度是否超过41℃,电气安全性是否良好。
4.2.3 审查要点
审查随附文件(使用说明书等),是否具有必要的操作说明,如使用前检查的内容、使用中的注意事项、使用后的处理等。
4.3 由不熟练/未经培训的人员使用
4.3.1 可能的危害:
硬性光学内窥镜必须由经必要培训而且操作熟练的医生使用,不然可能对患者产生严重 危害。
4.3.2 可采取的风险控制措施:
—编写培训资料,包括视频光盘;
—开办培训班;
—随附文件中给出必须由经过培训操作熟练的医生使用的警示。
4.3.3 审查要点
审查随附文件(使用说明书等),是否具有“必须由经必要培训而且操作熟练的医生使用”的内容和相关警示性说明。
4.4 对适应症和副作用的说明不充分
4.4.1 可能的危害:
硬性光学内窥镜与其他医疗器械一样,都有适应症、禁忌症和副作用,如果说明不充分,可能对患者产生严重危害。
4.4.2 可采取的风险控制措施:
—请有资历的临床医生充分说明适应症、禁忌症和副作用;
—编写的使用说明书关于适应症、禁忌症和副作用部分请有资历的临床医生审定。
4.4.3 审查要点:
—审查随附文件(使用说明书等),是否具有明确的适应症、禁忌症、副作用的充分说明和相关警示性说明。
—审查临床验证报告,并与使用说明书的适应症、禁忌症和副作用内容相比较。
4.5 与消耗品、附件、其他医疗器械不兼容
4.5.1 可能的危害
—硬性光学内窥镜使用时往往需要与消耗品、附件、其他医疗器械一起使用,它们之间是否相容,对安全影响很大。如硬性光学内窥镜与手术器械不兼容,造成手术器械无法顺畅插入,或无法出现在硬性光学内窥镜的视场中,导致危害发生。
4.5.2 可采取的风险控制措施:
—若有可能,通过实际试验,找出一批可与硬性光学内窥镜配合使用的消耗品、附件、其他医疗器械的清单供使用者选用;
—在使用说明书中将上述清单列出;
—在使用说明书中给出与不兼容的消耗品、附件、其他医疗器械共用会产生危害的警示性说明。
4.5.3 审查要点
—审查随附文件(使用说明书等),是否有与不兼容的消耗品、附件、其他医疗器械共用会产生危害的警示性说明;
—审查风险管理文件。
4.6 锐边与锐尖
4.6.1 可能的危害
如果硬性光学内窥镜或配合器械插入部分表面存在非期望的尖锐边缘或突出物等疵病,有可能损伤皮肤、粘膜、血管,甚至造成大出血。
4.6.2 可采取的风险控制措施
—通过设计、精密制造、良好的维护保养和使用前检查,确保硬性光学内窥镜的表面无非期望的尖锐边缘或突出物,手术器械的外表面光滑、杆部平直,无锋棱、毛刺及明显的碰伤和划痕。
—通过使用前仔细检查的提示 , 告知如发现有此类疵病 , 应及时处理 、修复 ,不能 使用。
4.6.3 审查要点
—审查产品技术要求中关于硬性光学内窥镜外表面质量要求的规定;
—审查注册检验报告中对硬性光学内窥镜外表面质量要求的检验结果;
—审查随附文件(使用说明书等),其中应有使用前检查硬性光学内窥镜外表面是否存在锐边与锐尖的注意事项。
4.7 角分辨力、颜色分辨能力和色还原性、边缘均匀性、综合光效、有效光度率、单位相对畸变性能不良
4.7.1 可能的危害
硬性光学内窥镜的角分辨力、颜色分辨能力和色还原性差,边缘均匀性、综合光效、有效光度率性能不好,单位相对畸变增大,可能影响医生的观察和操作,造成误诊或手术失败。
4.7.2 可采取的风险控制措施
通过设计、工艺和精密制造,改善硬性光学内窥镜的颜色分辨能力、色还原性能,边缘均匀性、综合光效、有效光度率,单位相对畸变性能。
4.7.3 审查要点
审查风险管理文件的相关内容,应有防止角分辨力、颜色分辨能力和色还原性差,边缘均匀性、综合光效、有效光度率性能不好,单位相对畸变大危害的描述。
4.8 接口混淆
4.8.1 可能的危害
硬性光学内窥镜有冲洗接口、送气接口和手术器械通道口,如若操作使用中接口混淆,显然会对患者造成伤害
4.8.2 可采取的风险控制措施
—将手术器械通道口、冲洗接口和送气接口等设计成不能互换的不同的型式;
—在随附文件中给出提示,要求与其他器械连接时,应绝对避免连错接口。
4.8.1 审查要点
—审查不同功能接口的型式是否不同;
—审查随附文件对避免接口混淆的警示。
5.功能性失效、维护和老化引起的危害
5.1 缺少维护规范和/或维护不适当
5.1.1 可能的危害:
—硬性光学内窥镜的维护保养应有适当的规范。如清洗规范、消毒灭菌规范、搬运储存规范等,不然会造成维护不当,破坏硬性光学内窥镜的性能;
—使用者未按规范进行适当的维护保养,破坏了硬性光学内窥镜的性能,如镜片发霉损坏、光轴偏离、密封性降低、导光纤维折断、视场变小、内部出现雾层、配套手术器械破坏等,可能对患者产生影响正确诊断等危害。
5.1.2 可采取的风险控制措施:
—编制合适的维护保养规范,请设计、使用的专家审定;
—在随附文件中给出上述维护规范和不按照规范维护会有严重后果的警示;
—对使用者进行适当的维护保养方面的培训。
5.1.3 审查要点:
—审查随附文件(使用说明书等),其中应有正确维护保养的内容。
5.2 对硬性光学内窥镜寿命期缺少适当的规定
5.2.1 可能的危害:
硬性光学内窥镜有一定的寿命期 , 在适当的寿命期外使用硬性光学内窥镜 , 会使风险增加。
5.2.2 可采取的风险控制措施:
—经过理论估计和实际试验,确定硬性光学内窥镜的适当的寿命期;
—在随附文件中告知该寿命期,并给出在适当的寿命期外使用硬性光学内窥镜具有危险的警告。
5.2.3 审查要点:
—审查风险管理文件,其中应有建议寿命期的内容和警示。
对以上每一可能的危害,审查风险管理文件的相关内容:
应有关于防电击措施、防超温措施、生物学评价、防止交叉感染、防止储存或运行偏离预定的环境条件和意外的机械破坏、防止不适当标记危害、防止不适当操作说明危害、防止由不熟练或未经培训的人员使用危害、防止适应症禁忌症和副作用说明不充分危害、防止与不兼容的消耗品、附件、其他医疗器械共用危害、防止锐尖锐边危害、避免接口混淆、防止维护规范和/或维护不适当危害、防止缺少寿命期规定危害等的描述(包括该危害的风险分析、降低该风险的措施、可接受水平或剩余风险等内容)
(八)产品技术要求范例
1.产品型号/规格及其划分说明
1.1 产品型号/规格及基本参数
存在多种型号的,应明确不同型号之间的异同,必要时可辅以图示,文本较大时可以附录形式提供,基本参数见表1。
表1.内窥镜型号表和基本参数

1.2 划分说明
如有,应提供,包括型号命名规则等。
2.性能指标
2.1 光学性能
2.1.1 视场角和视向角
2.1.1.1 视场角,
内窥镜视场角的设计值见表1,与厂家提供名义值的偏差最低要求为不大于15%,且应符合专用标准(如有)的要求。
2.1.1.2 视向角,θ
在光学镜上应标注视向角的名义值见表1,允差:θ≤30°时,允差:±3°;30<θ≤100时,允差:±10%;θ>100°时,允差:±10°,且应符合专用标准(如有)的要求。
2.1.2 像质
角分辨力
内窥镜视场中心角分辨力的标称值为××C/(°),允差-10%(上限不计),对应的设计工作距d0为××mm。应可在随附资料中查获。以相同光学工作距处的垂直视轴的平面作视场,在最大视场高度的70%位置上任选四个正交方位测量,平均角分辨力不低于实测的视场中心角分辨力的90%。
2.1.3 有效景深范围
内窥镜有效景深范围为XX—XXmm。应可在随附资料中查获。在该景深范围内,视场中心的角分辨力应不低于设计光学工作距处角分辨力测量值的80%。试验应至少包括有效景深范围的最远端。
2.1.4 视场质量
视场应无重影或鬼影、闪烁等效应,无可见杂质、气泡等缺陷。
2.1.5 颜色分辨能力和色还原性
内窥镜有良好的颜色分辨能力和色还原性。当采用ISO 10526:1999CIE S005 规定的A和D65标准照明体的光谱,经照明光路和成像系统传输后输出,其输出光谱仍能保持良好的显色性。在A标准照明体下的显色指数Ra的名义值为××,在D65标准照明体下的显色指数Ra的名义值为××,实测值不小于名义值。
2.1.6 照明变化率
内窥镜经灭菌消毒试验后,其照明光路的光能积分透过率应保持稳定,用输出光通量衡量,光通量变化率应不大于20%。
2.1.7 照明有效性
2.1.7.1 边缘均匀性
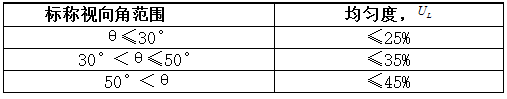
在有效景深范围内检查,照明光斑应充满视场的有效尺度,且在最大视场角的90%视场处的照度应均匀,在该视场带上选择四个正交方位测试,其均匀度UL应符合表2的要求
表2边缘均匀度要求
2.1.7.2 照明镜体光效
内窥镜在 的90%视场处的照明镜体光效 的名义值为××,照明镜体光效 的测定值应不小于名义值。
2.1.8 综合光效
内窥镜在 的90%视场处的综合镜体光效SLeR的名义值为××,测定值应不小于名义值。
综合边缘光效(SLe-Z)的名义值为××,测定值不小于名义值。
2.1.9 光能传递效率——有效光度率
内窥镜有效光度率的名义值为××,实测值应不大于名义值。
2.1.10 单位相对畸变
内窥镜在设计工作视场形状下/评价视场面形状下单位相对畸变的控制量为××,畸变一致性符合表3的要求。
表3 畸变一致性要求

2.1.11 照明光源和观察视场的重合性
在工作距离处照明光斑应充满视场,无明显的亮暗分界线。
2.2 机械性能
2.2.1 工作长度,L
内窥镜工作长度的标称值见表1,允差:±3%。
2.2.2 插入部分最大宽度
内窥镜插入部分最大宽度的标称值见表1,实测值不大于标称值。
2.2.3 器械通道最小宽度
对于含器械通道的内窥镜,该通道的最小宽度应不小于标称值,标称值见表1
2.2.4 目镜罩尺寸
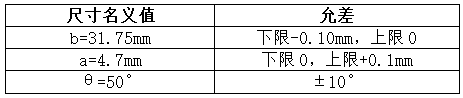
目镜罩的形状如图12所示,并且图12中的尺寸和允差应符合表4的规定。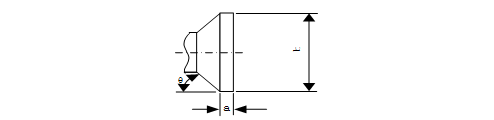
图12 目镜罩形状简图
表4尺寸和允差
2.2.5 配合
2.2.5.1 锁止和插拆
与镜鞘或镜桥、镜鞘配合,锁止与插拆应符合下述要求:
配合后应能锁止,锁止应可靠。
插入轻松自如、拆卸方便。
2.2.5.2 定位和密封
与镜鞘或镜桥、镜鞘配合后应满足下述要求:
锁止后应定位可靠,无松动现象;
锁止后应密封良好,做渗水性试验时1分钟内渗水不得超过5滴。
2.2.6 封装
2.2.6.1 雾层
含光学元件的内窥镜,封闭的内部应清洁干燥,经低温至高温突变试验后,内部无视场模糊现象。
2.2.6.2 封装可靠性
含光学元件的内窥镜应能承受如下密封性的试验不失效:
水下1m历时12h水压试验;
按制造商规定的灭菌或消毒方法循环20次试验。
2.2.7 连接
内窥镜各组件之间的连接牢固可靠,各连接部分,若采用紧配合方式连接,其配合处应无明显可见缝隙;若采用焊接方式连接,其焊缝处应无凹凸不均匀、脱焊、堆焊或明显的麻点现象;若采用胶合方式连接,其胶合处应无溢流或明显胶堆现象,其他部分无胶流纹痕。
2.2.8 插入部分外表面质量
插入部分除特殊目的外,不应有任何可能引起的安全伤害存在。
对于特殊目的的需要而存在可能引起安全伤害的插入部分,应采用所有可能方式,以使不希望的危害减至最小。所采取的方式中至少应包括在随附资料中的下述说明:
—警告可能出现的危害提示,危害的预防手段,以及危害发现后的处理说明;
—安全的操作规程;
—操作者需通过专门培训才能使用的声明。
2.2.9 表面和边缘
—内窥镜应当设计成对人体不会造成任何意外伤害。
—内窥镜的所有表面不得有细孔、裂纹和毛刺。
2.2.10 可重复消毒或灭菌产品的耐受性
对于可重复消毒或灭菌的硬性内窥镜,消毒或灭菌方法应既不能损坏产品的功能,也不能产生腐蚀。
2.2.11 电气安全性能要求
内窥镜与医用电气设备互连使用的安全要求应符合YY0068.4-2009中6的要求及GB 9706.1-2007、GB 9706.19-2000规定的要求。
2.2.12 环境试验
内窥镜的环境试验要求应符合GB/T14710-2009、GB 11244-2005中气候环境试验I组、机械环境试验I组的规定,并按附录A的规定进行试验。部分内窥镜有现行行业标准的,则环境试验要求应符合内窥镜行业标准中的具体要求。
3.试验方法
3.1 光学性能试验方法
3.1.1 视场和视向的测定
按照YY 0068.1-2008中5.1规定的方法进行检测,应符合2.1.1.1和2.1.1.2的要求。
3.1.2 像质角分辨力的测定
按照YY 0068.1-2008中5.2.1规定的方法进行检测,应符合2.1.2的要求。
3.1.3 有效景深范围的测定
按照YY 0068.1-2008中5.2.2规定的方法进行检测,应符合2.1.3的要求。
3.1.4 视场质量的测定
按照YY 0068.1-2008中5.2.3规定的方法进行检测,应符合2.1.4的要求。
3.1.5 颜色分辨能力和色还原性的测定
按照YY 0068.1-2008中5.3规定的方法进行检测,应符合2.1.5的要求。
3.1.6 照明变化率的测定
按照YY 0068.1-2008中5.4.3规定的方法进行检测,应符合2.1.6的要求。
3.1.7 照明有效性的测定
3.1.7.1 边缘均匀性UL的测定
按照YY 0068.1-2008中5.4.4.1规定的方法进行检测,应符合2.1.7.1的要求。
3.1.7.2 照明镜体光效的测定
按照YY 0068.1-2008中5.4.4.2规定的方法进行检测,应符合2.1.7.2的要求。
3.1.8 综合光效的测定
按照YY 0068.1-2008中5.5规定的方法进行检测,应符合2.1.8的要求。
3.1.9 光能传递效率——有效光度率的测定
按照YY 0068.1-2008中5.6规定的方法进行检测,应符合2.1.9的要求。
3.1.10 单位相对畸变的测定
按照YY 0068.1-2008中5.7规定的方法进行检测,应符合2.1.10的要求。
3.1.11 照明光源和观察视场的重合性的测定
按照GB 11244-2005中5.6规定的方法进行检测,应符合2.1.11的要求。
3.2 机械性能试验方法
3.2.1 工作长度、插入部分最大宽度、器械通道最小宽度、目镜罩尺寸的测定
按照YY 0068.2-2008中5.1规定的方法进行检测,应符合 2.2.1 、2.2.2 、2.2.3 、2.2.4 的要求。
3.2.2 配合性能的测定
3.2.2.1 锁止和插拆的测定
按照YY 0068.2-2008中5.2.1规定的方法进行检测,应符2.2.5.1的要求。
3.2.2.2 定位和密封的测定
按照YY 0068.2-2008中5.2.2规定的方法进行检测,应符合2.2.5.2的要求。
3.2.3 封装的测定
3.2.3.1 雾层的测定
按照YY 0068.2-2008中5.3.1规定的方法进行检测,应符合2.2.6.1的要求。
3.2.3.2 封装可靠性的测定
按照YY 0068.2-2008中5.3.2规定的方法进行检测,应符合2.2.6.2的要求。
3.2.4 连接性能的测定
按照YY 0068.2-2008中5.5规定的方法进行检测,应符合2.2.7的要求。
3.2.5 插入部分外表面质量的测定
按照YY 0068.2-2008中5.6规定的方法进行检测,应符合2.2.8的要求。
3.2.6 表面和边缘检查
按照GB 11244-2005中5.1规定的方法进行检测。应符合2.2.9的要求。
3.2.7 可重复消毒或灭菌产品的耐受性
按照使用说明书规定的消毒或灭菌方法重复20次试验,对于浸泡消毒的方法,可按20倍使用说明书规定的浸泡时间来试验检验,结果应符合2.2.10的要求。
3.2.8 电气安全性能
按YY0068.4-2009、GB 9706.1-2007、GB 9706.19-2000规定的方法进行检测,结果应符合2.2.11的要求。
3.2.9 环境试验
按附录A的要求试验,结果应符合2.2.12的要求,如部分内窥镜有现行行业标准,则环境试验应按内窥镜行业标准中的方法进行试验。

欢迎关注《医疗装备》官方公众号