发布时间:2025-04-27 10:15:53 浏览 次
作者:卢彦宏,李爱伟,张志清
单位:山西省检验检测中心·山西省标准计量技术研究院 (山西太原 030001)
〔关键词〕一次性医用防护服;环氧乙烷残留量;解析;浸提时间
〔中图分类号〕R187.2 〔文献标识码〕B
〔文章编号〕1002-2376(2025)04-0038-03
环氧乙烷又名氧化乙烯,是一种比较简单的环醚有机化合物,其化学式为 C2H4O,常温下为无色气体,具有低沸点、易挥发、易燃易爆的特性,并且具有较强的扩散和穿透能力 [1],对细菌芽孢、真菌和病毒等各种微生物均有显著的灭杀作用,所以被学术界广泛推荐为医疗用品及手术器具的消毒方式 [2-3]。但环氧乙烷也是一种中枢神经抑制剂,有致突变性和致畸特性 [4-8]。国际癌症研究中心对环氧乙烷潜在化学致癌性物质的分类为 G1,明确为人类致癌物 [9]。GB 19082—2009《医用一次性防护服技术要求》[10]、YY/T 0969—2013《一次性使用医用口罩》[11] 及 YY0469—2011《医用外科口罩》[12]均对环氧乙烷的残留量设定了明确的安全限值(10μg/g)。因此,在经环氧乙烷消毒产品的质量评判标准中,环氧乙烷残留量是一个强制性的安全指标。本实验室团队近 4 年对 200 余批次一次性医用防护服进行的监督检验中发现,被检样品中存在环氧乙烷残留量超标现象,且环氧乙烷残留量并不随放置时间延长而明显降低,或解析至符合标准要求。为此,针对某批次异常样品开展了探索性跟踪检测,旨在提高一次性医用防护服产品的质量安全。
1 对象与方法
1.1 研究对象
实验室检测中,发现某厂家于 2021 年 12 月生产的某批次环氧乙烷残留量超出标准规定限值10 μg/g 的一次性医用防护服。
1.2 方法
1.2.1 试验原理
环氧乙烷的沸点约为 10.4~10.8 ℃ [8,12-14](截至目前不同文献表述不同),故在室温下其残留量应为气体。无菌医疗器械经环氧乙烷灭菌后,解析时间一般为 7 ~ 14 d。实验室收到样品时,样品距出厂时间约为半年,理论上样品中环氧乙烷残留量的检测结果应 <10 μg/g。针对检测中发现的异常情况,本研究采用样品分部位检测 + 留样不定期跟踪检测 + 样品不同浸提时间检测的试验设计方案。
根据 GB 19082—2009《医用一次性防护服技术要求》[1] 和 GB/T14233.1—2008《医用输液、输血、注射器具检验方法 第 1 部分:化学分析方法》[15] 配置环氧乙烷系列标定溶液:取 5 mg/ml 的环氧乙烷标准溶液,稀释为 1 组含有 5 个不同浓度(0.2 ~5.0 μg/ml)的系列标定溶液,随后精密量取 5 ml,置于 20 ml 萃取容器中密封待用。记录环氧乙烷峰面积,绘制标准曲线。依据式(1)计算医用防护服中环氧乙烷残留量,用相对含量(μg/ml)表示。
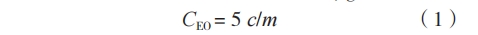
式中,CEO 为单位产品中环氧乙烷相对含量(μg/g);5 为量取的浸提液体积(ml);c 为标准曲线上供试液的浓度(μg/ ml);m 为称样量(g)。
1.2.2 试验材料
仪器:Agilent 生产的 7890B 气相色谱仪、7697A顶空自动进样器,氢火焰离子化检测器,HP-PLOT/Q-PT 色谱柱。柱箱温度 60 ℃,平衡时间 40 min;进样口温度 200 ℃;检测器温度 250 ℃(工作条件)。
标准品:环氧乙烷标准溶液 5 mg/ml(坛墨质检标准物质中心)。样品:与环氧乙烷残留量合格样品一起存放于留样室的该批次异常医用防护服。对照品:与环氧乙烷残留量合格样品一起存放于留样室的其他 2 个不同厂家的医用防护服。备检样(供试液):按照 GB/T14233.1—2008《医用输液、输血、注射器具检验方法 第 1 部分:化学分析方法》[15] 中 9.4 条款规定,以水为溶剂进行平行试验的极限浸提法备样,将选择的拟检样品剪成长度为 5 mm 的碎块,取约 1.0 g 放入 20 ml 萃取容器中,精密加水 5 ml,密封后置于气相色谱顶空进样器上,待测。
1.2.3 样品分部位检测试验
基于目前国内外医院使用的医用防护服大部分原料是以非织造布为主的即弃型复核材料 [16],主要面料是高阻隔性材料,如聚乙烯、聚丙烯等。防护服主体部位颜色为白色,拉链和密封条一般为蓝色。根据选定的某 1 批次异常样品的留样数量设计本试验,分析样品中不同材质部位环氧乙烷残留量的权重,或证明蓝色部分的残留量高于白色部分的先验观点。
检样制备:连续 13 d,自包装启封之日起每天定点将同 1 件该批次独立包装的防护服按部位分别制备 a(全是白色部分组成的备检样)、b(按照白色和蓝色部分的质量比,称取样品混合组成备检样)、c(全是蓝色部分组成的备检样)3 份备检样;自包装启封之日起每天定点将同等条件存放的其他 2 个不同厂家环氧乙烷残留量在限值规定范围内的防护服,也按前述方式制备对照样各3 份(共 6 份)备检。
检测方法:连续 13 d 内,将制备好的 9 份样品实施并列检测,分析数据变化特征。
1.2.4 留样不定期跟踪检测试验
设计试验分析该批次样品环氧乙烷残留量随放置(解析)时间的延长所表现的变化特征。
检样制备:以出厂 6 个月时(2022 年 6 月)接受首次检测所依据的 GB 19082-2009[1] 中制备方法,制备类似备检样。
检测方法:该批次样品出厂 15 个月(2023 年3 月)时,再次检测样品的环氧乙烷残留量,分析数据变化走势。
1.2.5 样品不同浸提时间检测试验
鉴于 GB 19082—2009《医用一次性防护服技术要求》[1] 与 GB/T14233.1—2008《医用输液、输血、注射器具检验方法 第 1 部分:化学分析方法》[15]对以水为溶剂进行平行试验极限浸提法的规定中,未提及将样品放入萃取容器中加水密封后需浸提多久开始检测,设计试验确认该批次样品的环氧乙烷残留量与其备检样浸提时间长短的相关性。
检样制备:取 1 件该批次独立包装样品,同时制备 24 份平行试样备检。
检测方法:通过气相色谱仪对 24 份平行试样开展每 6 小时检测 2 份试样,共检测 12 次,采用均值表征法分析数据变化走势。
1.3 观察指标
(1)一次性医用防护服环氧乙烷残留主要来源(蓝色或白色部位)及残留量随包装打开时间的变化。(2)距出厂 6、15 个月后,该批次异常一次性医用防护服中环氧乙烷的残留量及其变化。(3)观察随供试液放置时间的延长,该批次异常一次性医用防护服中环氧乙烷残留量的变化。
2 结果
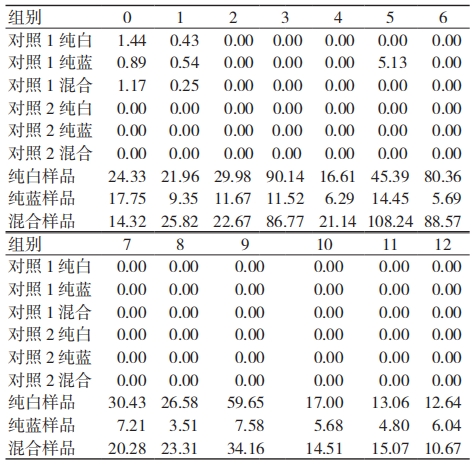
2.1 一次性医用防护服环氧乙烷残留的主要来源及随包装打开时间变化的残留情况
一次性医用防护服中环氧乙烷残留主要来源于白色部位,随着包装打开时间的延长环氧乙烷残留量呈下降趋势,见表 1。
表 1 一次性医用防护服环氧乙烷残留的主要来源和时间变化
2.2 一次性医用防护服中环氧乙烷残留量留样不定期跟踪监测实验结果
出厂 6 个月后,该批次一次性医用防护服的环氧乙烷残留量检测结果为 18.8 μg/g;出厂 15 个月后,该批次一次性医用防护服的环氧乙烷残留量检测结果为 15.5 μg/g,依然超过标准规定的限值。
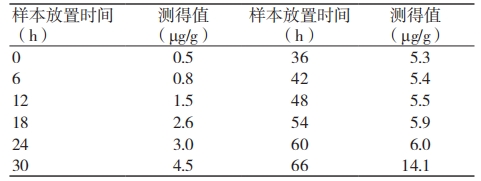
2.3 一次性医用防护服环氧乙烷残留量样品不同浸提时间检测结果
2023 年 7 月检测实验结果表明,随着供试液放置时间的延长,环氧乙烷残留量呈上升趋势,见表 2。
表 2 环氧乙烷残留量随供试液放置时间的变化
3 讨论
环氧乙烷在常温下呈气态,饱和蒸气压高,被广泛应用于医疗器械灭菌。然而,环氧乙烷对人体的危害性不容小觑,因此国家及医药行业标准对其残留量均明确规定了限值(10 μg/g)。实验室对市场上一次性医用防护服的检测中,发现 95% 以上的样品环氧乙残留量均在标准规定限值范围内,但存在少数产品超过限值,甚至在室温条件下放置半年后仍旧超出限值的现象。本研究针对异常样品进行检测。
通过跟踪检测该批次异常样品发现,生产后15 个月环氧乙烷残留量并未随放置时间延长而明显降低,或解析至符合标准要求。异常特征表现为以下 3 点。(1)环氧乙烷残留量的分布与开封后放置时间存在显著相关性;对照防护服及该批次异常防护服的环氧乙烷残留主要来源于防护服的白色部位,蓝色部位对其影响微乎其微;该异常样品随着开封后时间的延伸,环氧乙烷残留量呈明显下降趋势,即外包装对环氧乙烷解析至关重要。(2)环氧乙烷残留量与其留置时间(解析时间)无明显相关性;环氧乙烷沸点较低,其在一次性医用防护服中的残留量应随放置时间的延长而相应降低;一般情况下,纸塑包装灭菌后 7 d、全塑包装灭菌后 14 d 的环氧乙烷残留量应可达到国家标准 [17];但实验证明,该批次一次性医用防护服在室温放置15 个月后的环氧乙烷残留量依然高于限值 10 μg/g。(3)环氧乙烷残留量与其检测浸提时间(供试液放置时间)显著相关;该异常样品制备的供试液放置时间越长,环氧乙烷残留量检测值越高,即在浸提液中,样品的环氧乙烷残留会随时间推移不断析出(理论上应该有极限,但在有限时长的实验中未观察到)。
综上所述,尽管该批次样品从原材料外观、质地与其他合格产品无差异,但其异常表现应当还是因其原材料特性所致,如白色面料或喷涂了不明聚合物,或附着有纳米(分子)凝胶类物质,后续有必要进一步对其原材料特性进行探讨。
【参考文献】
[1]薄亚莉,王卉 . 环氧乙烷健康危害研究现状 [J]. 职业与健康,2019,35(15):2157-2160.
[2]徐燕,孙巍,吴晓松.环氧乙烷灭菌技术应用与发展 [J].中国消毒学杂志 , 2013,30(2):146-151.
[3]朱瑞银,陆蓓,何忠平.无菌医疗器械环氧乙烷灭菌的验证方法 [J].中国医疗器械信息,2008,14(9):10-13,17.
[4]黄鸿新,胡昌明,刘文一,等 . 医疗器械环氧乙烷灭菌实施参数放行的研究 [J]. 中国医疗器械杂志,2022,46(5):574-577.
[5]任道凤,顾祖维 . 环氧乙烷致癌、致突变和致畸研究的进展 [J].铁道劳动安全卫生与环保,1987,34(3):64-66.
[6]刘柏东,贺伟罡,陈敏 . 医疗器械中环氧乙烷灭菌残留物的来源分析 [J]. 中国医疗器械杂志,2020,44(5):443-447.
[7]姚天平,钱心依 . YY0336-2020《一次性使用无菌阴道扩张器》标准解析 [J]. 医疗卫生装备,2022,43(1):85-88.
[8]Shintani H. Ethylene oxide gas sterilization of medical devices[J]. Biocontrol Sci, 2017, 22(1): 1-16.
[9]国家食品药品监督管理局 . 医用一次性防护服技术要求:GB19082—2009[S]. 北京:中国标准出版社,2010.
[10]国家食品药品监督管理局 . 一次性使用医用口罩:YY/T 0969—2013[S]. 北京:中国标准出版社,2014.
[11]国家食品药品监督管理局 . 医用外科口罩:YY0469—2011[S]. 北京:中国标准出版社,2013.
[12]刘若锦,王子梦,李辉,等 . 基于多组件医疗器械产品的环氧乙烷残留量检测方法研究 [J]. 医疗卫生装备,2024,45(1):56-61.
[13]王利莎 . 防护产品灭菌及残留环氧乙烷的检测 [J]. 纺织检测与标准,2021,7(6):5-8.
[14]闫顺华,罗明,朱毅忠,等 . 气相色谱法测定医疗防护用品中间品中环氧乙烷残留量 [J]. 化学分析计量,2021,30(3):56-59.
[15]国家技术监督局 . 医用输液、输血、注射器具检验方法 第1部分:化学分析方法:GB/T 142333.1-2022[S]. 北京:中国标准出版社,2023.
[16]陈诗萍, 陈旻, 魏岑 , 等 . 医用防护服的构效特点及其研发趋势 [J]. 纺织学报,2020,41(8):179-187.
[17]兰海,乔燕,李志刚 . 纸塑包装减少环氧乙烷残留评价分析 [J]. 湖南中医药大学学报,2013,33(12):8-9
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号