发布时间:2025-03-13 13:25:58 浏览 次
作者:许江滨1,巩孔臻1,赵玉娟2,于文雯3,李霞2(通信作者)
单位:1 山东大学第二医院 (山东济南 250033);2 山东省药品不良反应监测中心 (山东济南 250014);3 济南市药品不良反应和医疗器械不良事件监测中心 (山东济南 250101)
〔关键词〕医疗器械;风险管理;吻合器;不良事件
〔中图分类号〕R197.39 〔文献标识码〕A
〔文章编号〕1002-2376(2025)02-0031-05
基金项目:山东省医疗器械不良事件监测哨点研究课题(2023SDADRKY03)
医疗器械不良事件是指已上市医疗器械在正常使用情况下发生的,导致或可能导致人体伤害的各类有害事件 [1-3]。2021 年世界卫生组织(World Health Organization,WHO)通过的《2021 — 2030 年全球患者安全行动计划》中指出,低收入和中等收入国家的住院治疗每年将导致 1.34 亿起不良事件,造成 260 万人死亡 [4]。目前,医疗安全(不良)事件的报告和处置已成为 WHO 关注的焦点 [5]。
吻合器是外科手术常用医疗器械,可有效提高手术效率,完成传统手工吻合难以处理的困难部位吻合操作,对手术的顺利开展具有重要作用 [6-7]。吻合器一旦发生故障,将严重影响手术的进程,甚至手术效果。有研究显示,吻合器位列美国急症医学研究所(American Institute of Emergency Medicine,ECRI)公布的既往不良事件报告可能性及严重程度排序前十位 [8]。我国同样重视吻合器的安全问题。国家药品监督管理局于 2020 年发布公告提醒医疗机构关注吻合器类产品的使用风险 [9]。
风险管理理论起源于美国,1930 年正式以管理科学的方式被提出 [10]。风险管理是指如何在项目或企业等风险环境中将风险降至最低的管理过程,具体包括风险识别、风险评估、风险控制 3 个环节。近年来,越来越多的研究者开始关注医疗器械领域的风险管理,并形成了一系列知识框架体系和理论,为有效实施医疗器械风险管理和质量控制夯实了基础 [11-19]。但目前关于医疗器械不良事件的风险管理研究多集中于低值非手术类耗材,对外科手术用器械不良事件的研究较少。而关于吻合器的研究多关注于标准体系的建立和临床价值评价指标 [20-21],对吻合器不良事件的分析和追溯研究较少。因此,本研究通过对已发生的吻合器不良事件进行风险管理研究,明确其危险因素及针对性干预措施,为保障患者安全、促进医疗质量持续改进提供参考依据。
1 数据来源
收集山东省 2019 年 1 月至 2022 年 12 月期间的 287 例吻合器不良事件监测数据,主要指标包括报告来源、发生年度、患者性别和年龄、产地、管理类别及不良事件发生情况和导致的后果等。
采用半结构性访谈的方式与吻合器生产厂家技术人员及胃肠外科、胸外科临床医师进行访谈,内容包括常见的吻合器不良事件表现、解决方案及避免不良事件的建议,从厂家和使用者的角度共同讨论吻合器的不良事件风险管理。
2 数据处理方法
利用 Excel 和 SPSS 22.0 等软件进行数据录入和统计分析。 计数资料以率表示, 采用 χ2 检验。影响因素采用多因素二元 Logistic 回归分析。P< 0.05 为差异有统计学意义。
3 结果
3.1 风险识别
3.1.1 报告来源
吻合器不良事件报告主要来源于三级综合医院,占比达 71.43%,见表 1。
表 1 287 例吻合器不良事件的报告来源情况
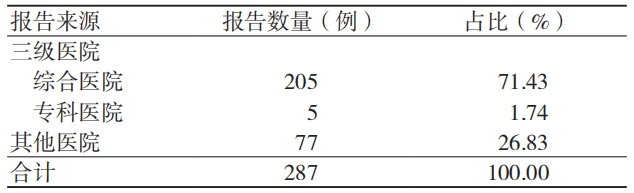
3.1.2 发生年度及严重伤害
吻合器不良事件的上报例数及严重伤害的占比逐年上升,2022 年严重伤害占比较 2019 年增加22.86%,见表 2。
表 2 287 例吻合器不良事件的发生年度及严重伤害占比
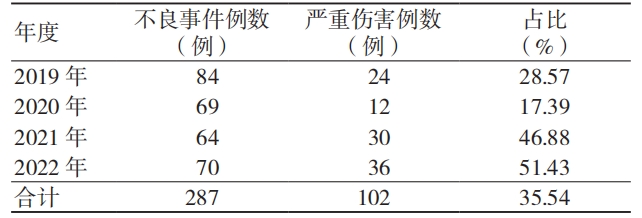
3.1.3 患者的性别和年龄及吻合器的产地和管理类别
吻合器不良事件涉及的患者中男性占比高于女性,≥ 60 岁年龄段的占比最高,国产吻合器占比高于进口吻合器,Ⅱ类产品占比高于Ⅲ类产品,见表 3。
表 3 287 例吻合器不良事件涉及的患者情况及产品产地和管理类别
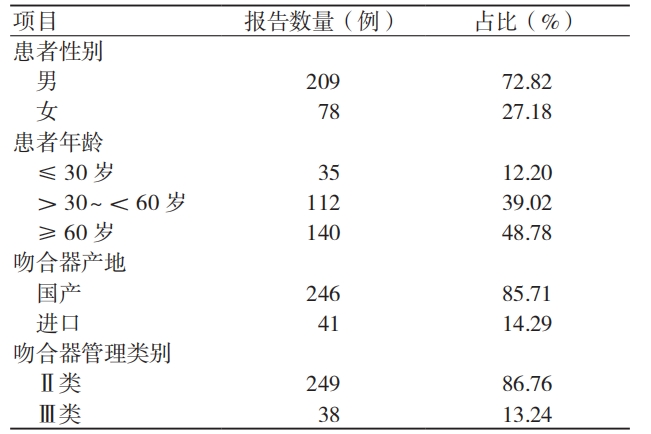
3.1.4 吻合器不良事件故障表现
无法击发 / 击发不全是吻合器不良事件最常见的故障表现,见表 4。
表 4 287 例吻合器不良事件的故障表现

3.2 风险评估
风险评估是医疗器械风险管理的重要环节,旨在对已识别的风险进行评估和量化,以便更好地理解其严重性,并为风险管理提供依据。
3.2.1 不良事件原因的描述性分析
吻合器不良事件的主要原因可归类如下。(1)吻合器无法击发。可能与吻合器、钉仓连接处固定不稳、松动或卡死、吻合器击发按钮由于外力原因脱落有关。(2)吻合器击发后钉仓闭合不严,无法完全闭合组织或皮肤。可能与使用者未正确操作、钉仓产品质量问题有关。(3)吻合器击发吻合后,吻合钉松动造成组织或皮肤再出血。可能与使用者选取的钉仓高度不合适或击发夹闭角度不合适、钉仓产品质量问题、使用者未正确安装及操作吻合器有关。
3.2.2 不良事件严重程度的影响因素分析
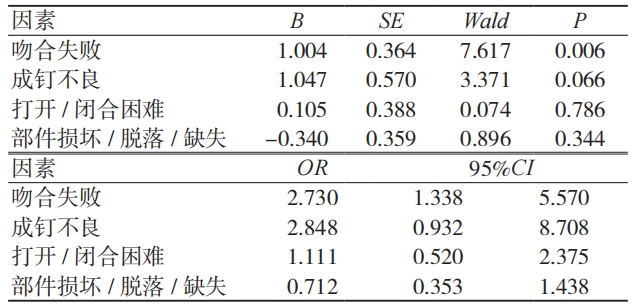
按照吻合器伤害程度进行单因素卡方检验和多因素二元 Logistic 回归分析。纳入的影响因素包括医疗机构类别、患者性别、患者年龄、产品产地、产品管理类别、故障表现 6 个因素。单因素分析结果显示,故障表现是不良事件对患者产生严重伤害的影响因素(P< 0.05)。二元 Logistic 回归分析结果显示,吻合失败是造成严重伤害的危险因素(P< 0.05)。见表 5、表 6。
表 5 不良事件严重程度影响因素的单因素分析[ 例(%)]
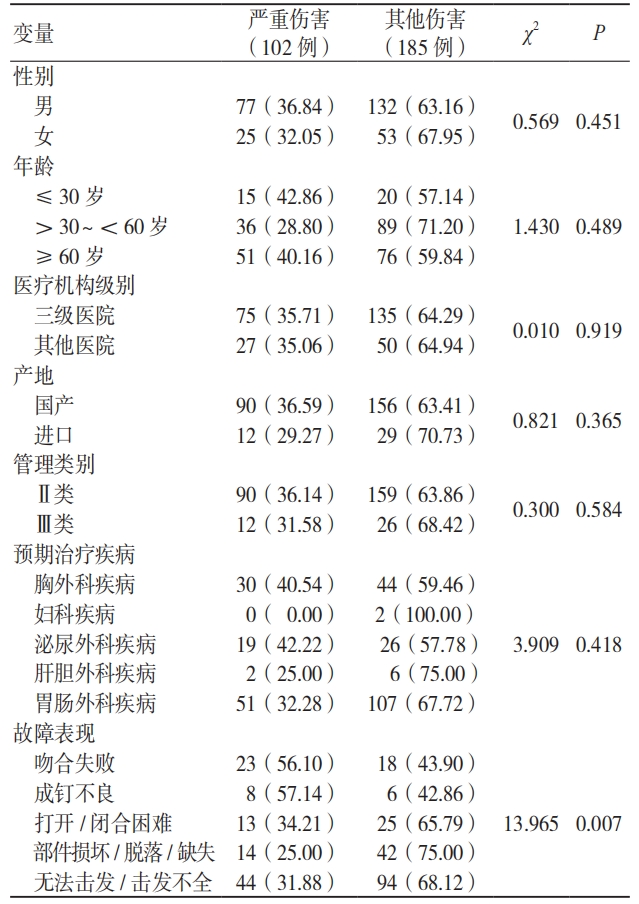
表 6 不良事件严重程度影响因素的二元 Logistic 回归分析结果
3.2.3 不良事件报告延迟情况
《医疗器械不良事件监测和再评价管理办法》[22]中要求,导致死亡的不良事件应在 7 日内报告,其他伤害应当在 20 日内报告。287 例不良事件报告中,延迟时间(事件发生日期和报告日期的差距)超过 20 天的不良事件报告共有 53 例。按照上述要求,本研究中吻合器不良事件上报延迟率为 18.47%。
3.3 风险控制
287 例不良事件上报后,生产厂家对其中 283 例开展调查,占比为 98.61%。4 例未开展调查的不良事件涉及生产厂家认为该事件由使用者操作原因造成,与产品质量无关。
287 例不良事件上报后,其中 173 例不良事件涉及厂家开展了相应的风险控制干预,占比60.28%。具体措施包括:(1)定期对医务人员进行使用培训和沟通,规范医师的使用操作流程;(2)加强质量生产管控。未采取干预的原因主要包括以下两方面:(1)厂家认为事件为个例,其他医疗机构未上报类似不良事件;(2)厂家未收到发生不良事件的器械,无法判断不良事件是否与产品有关,因此无法采取干预措施。
3.4 定性访谈分析结果
对生产厂家技术人员和临床医师的访谈结果显示,实际工作中最常见的不良事件为无法击发,解决方案为更换吻合器并将故障吻合器返厂检修。
导致吻合失败的最可能原因为钉仓高度选择不恰当。钉仓高度的选择主要依赖医师的经验和钉仓外包装上的标识。但由于患者病情各异,钉仓的选择更依赖于临床医师的经验。因此,为避免吻合失败,临床医师需不断地积累经验。导致无法击发的原因可能为术者使用前误触发保护装置,或钉仓和吻合器未正确组合安装,或吻合器无电 / 电量不足,或产品本身设计缺陷导致的质量问题。
4 讨论
4.1 吻合器不良事件报告风险识别分析
本研究发现,2019 — 2022 年山东省吻合器不良事件上报例数逐年增加的原因可能包括两方面。(1)中国医疗器械市场规模从 2016 年的 3 700 亿元增长至 2021 年的 9 630 亿元,年均复合增长率为 21.08%,其中包括越来越多的吻合器被投入临床使用 [23]。(2)国家出台的相关管理规章制度逐步健全,进一步规范医疗机构制定更明确不良事件上报流程的管理,同时不断强调“可疑上报”原则,提高了不良事件上报的积极性和规范性。
根据对吻合器上市许可持有人统计,国产吻合器的不良事件上报数量明显高于进口产品,这与目前我国市面上吻合器生产企业的分布情况有关。有报告指出,我国共 100 多家企业生产销售吻合器,而在我国销售吻合器的进口企业仅 2 家 [24]。因此,国产吻合器使用数量大幅领先于进口产品。另外,国产吻合器多为Ⅱ类医疗器械。根据山东省第三批医用耗材带量采购中选目录可知,仅 2 家国产Ⅲ类吻合器,其余均为Ⅱ类吻合器 [25]。Ⅱ类吻合器不良事件频发的现象也提醒医疗器械注册管理部门,需要加强对国产吻合器的注册审批管理,加大注册审批力度。
本研究结果显示,无法击发 / 击发不全为吻合器最常见的不良事件故障表现,占比 48.08%。与张道君等 [26] 的研究结果一致。临床医师普遍认为使用安全性是选择吻合器的最重要因素。吻合器最主要的作用是组织离断、切除、吻合,而无法击发 /击发不全是吻合器安全性不足的表现,直接影响手术效果。本研究通过数据分析和总结访谈结果发现,无法击发 / 击发不全的主要原因是吻合器使用者未按照正确步骤操作,同时与器械的结构构造是否合理、术者操作的熟练程度有关,提示厂家需要做好产品的研发和医务人员的使用培训工作。
4.2 吻合器不良事件报告风险评估分析
单因素和多因素分析结果显示,不良事件是否导致严重伤害与故障表现密切相关,尤其是吻合失败更易导致严重伤害。与手术医师交流该结论后得知,吻合失败可能导致组织出血、感染、再次手术等一系列问题,因此对患者造成严重伤害的可能性更高。
不良事件的风险评估应及时有效。但本研究发现,吻合器不良事件上报延迟率为 18.47%,且存在错报、误报情况。万里等 [27] 2022 年的研究发现,医务人员对不良事件的填写要求和规范了解不全导致不良事件报告质量偏低。结合医院实际工作情况,医务人员日常工作繁忙,尤其是不良事件发生后需第一时间处理该事件带来的一系列延续问题,常导致不良事件的上报工作延后,而时间差和依靠回忆撰写报告可能导致上报信息不准确。因此,医疗机构各部门上报不良事件过程中需要再次核实数据,以免出现错误报告影响国家监管层面对不良事件风险的预警。另外,医疗机构需要完善基础信息平台数据,借助信息软件进行医疗器械不良事件的报告、评价和反馈工作。
4.3 吻合器不良事件报告风险控制分析
国家市场监督管理总局于 2022 年颁布的《医疗器械生产监督管理办法》[28] 中明确要求,生产企业应主动开展产品不良事件监测,做好收集、上报、调查、评价及处置工作,根据产品的临床使用风险监测情况及时采取针对性控制措施(如修订完善使用说明书、发布警示信息、主动召回等)。本研究结果显示,不良事件的分析和再评价比例较低,表明不同生产厂家对及时按规处理不良事件报告的依从性和重视度存在差异,主体责任落实情况存在较大差距,部分厂家存在认知度不够、能力不足的问题,未形成完整的不良事件报告闭环管理 [29]。因此,生产厂家应积极配合医疗机构对已发生不良事件的产品进行调查和分析,从产品的结构设计、材质工艺等方面进行升级改进。但有研究指出,生产厂家由于担心公开不良事件可能对企业声誉和产品销售产生负面作用,导致开展不良事件分析和再评价的主动性和积极性不高 [30]。
综上所述,本研究认为医疗器械不良事件的利益相关者需要从各自的角度完善吻合器的风险管理工作。首先,生产厂家需加强质量控制和安全管理并持续关注产品的不良事件监测,主动进行不良事件的分析和再评价工作。其次,医疗器械不良事件监管部门需建立长效反馈机制,及时将风险信号传递至医疗机构。再次,医疗机构需基于循证证据并结合临床实践经验及医务管理部门的意见,建立吻合器合理安全使用的临床路径及标准,重视医疗器械的使用培训工作。最后,医务人员需严格按照医疗器械的使用说明书操作,及时上报医疗器械的不良事件。
【参考文献】
[1]王兰明.医疗器械不良事件监测——现状与展望 [J]. 中国医疗器械杂志,2004,28(4):282-289.
[2]鄂恒,刘禹,李丹.医疗器械不良事件案例分析与监 测管理改 进 探讨 [J]. 中国医疗器械信息,2019,25(9):179-180.
[3]侯凤.医疗器械不良事件案例分析及监测管理措施 [J].中国药物与临床,2021,21(22):3767-3768.
[4]美国国家科学院、工程院和医学院 . 跨越全球质量鸿沟,改善全世界卫 生保 健 [EB/OL].(2019-08-20)[2022-03-09].https://www.sohu.com/a/335154169_762408.
[5]霍添琪,尹畅 . 我国医疗安全(不良)事件管理现状分析及思考 [J]. 中国卫生质量管理,2021,28(3):41-43.
[6]张忠涛,陈凛,李乐平,等 . 胃肠外科手术缝合技术与缝合材料选择中国专家共识(2018版)[J]. 中国实用外科杂志,2019,39(1):27-33.
[7]赵沛,张太平 . 消化道重建基本原则与基本技术 [J].中国实用外科杂志,2014,34(3):197-204.
[8]张素敏 . 2010 年前十位的医疗技术危害 [J]. 中国药物警戒,2010,7(10):636-640.
[9]国家药品监督管理局.关注吻合器类产品使用风险 [EB/OL].(2020-03-11) [2024-07-27]. https://www.nmpa.gov.cn/xxgk/yjjsh/ylqxblshjtb/20200311102101923.html.
[10]张丽 . 我国医疗机构医疗器械不良事件风险管理研究 [D]. 北京:首都经济贸易大学,2014.
[11]赵建霞 . 风险管理在医疗器械管理中的应用研究 [J]. 中国设备工程,2023(17):55-57.
[12]李霞,杨锋,赵玉娟,等 . 医疗器械不良事件监测及风险控制管理方法 [J]. 中国设备工程,2023(15):198-200.
[13]胡家兴,邸新宇 . 医院医疗器械管理中风险管理的实施与效果观察 [J]. 中国医疗器械信息,2023,29(14):167-169.
[14]徐君,赵普宇,马天棚,等 . 医疗器械的风险管理与质量控制 [J]. 中国医疗器械信息,2023,29(7):4-7.
[15]兰宇 . 医院医疗器械管理中风险管理应用及探索 [J].中国医疗器械信息,2023,29(4):166-169.
[16]谢松波 . 风险管理在医院医疗器械管理中的应用分析 [J]. 中国医疗器械信息,2023,29(1):156-159.
[17]牟宗峰,安玉霞,牟强善,等 . 某三级乙等综合医院354 例医疗器械不良事件报告分析 [J]. 中国医疗器械信息,2019,25(7):15-16,19.
[18]陈娜群 . 185 例医疗器械不良事件分析与思考 [J]. 中国医疗器械信息,2021,27(7):30-33.
[19]赵亚丽,殷志红,刘小华,等 . 我院近六年348例医疗器械不良事件报告分析 [J]. 中国医疗设备,2019,34(9):132-135.
[20]花松鹤,沈佳琳,张培茗,等 . 完善吻合器系列标准体系的探讨和思考 [J]. 中国医疗器械信息,2023,29(19):43-46,57.
[21]陈文,孙黄颖,宣建伟,等 . 吻合器临床价值评价指标的探索性研究 [J]. 中国医学装备,2021,18(12):120-125.
[22]国家市场监督管理总局,国家卫生健康委员会 . 医疗器械不良事件监测和再评价管理办法 [EB/OL].(2018-08-13). https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/bgt/art/2023/art_4b69cde387db4c4fa4465aad987157e0.html.
[23]艾媒网 . 2021年中国医疗器械行业发展分析:预计2022年市场规模可突破12 500 亿元 [EB/OL].(2022-03-29).https://www.iimedia.cn/c1020/84434.html.
[24]中国药品监督管理研究会 . 医疗器械蓝皮书:中国医疗器械行业发展报告(2020)[M]. 北京:社会科学文献出版社,2020.
[25]山东省医疗保障局 . 关于执行山东省第三批医用耗材和省际联盟关节骨水泥类医用耗材集中带量采购结果的通知:鲁医保函 〔2023〕55号 [EB/OL].(2023-09-08 )[2024-07-27].http://ybj.shandong.gov.cn/art/2023/9/8/art_65415_10307121.html.
[26]张道君,唐雯,于琦 . 探索吻合器行业标准中可能存在的问题 [J].中国医疗器械信息,2020,26(3):10-11.
[27]万里,杨宁,金剑 . 医院医疗器械不良事件管理实践的分析与探讨 [J]. 中国医疗设备,2022,37(9):134-137,141.
[28]国家市场监督管理总局 . 医疗器械生产监督管理办法 [EB/OL].(2022-03-10)[2024-04-11]. https://www.samr.gov.cn/zw/zfxxgk/fdzdgknr/fgs/art/2023/art_fc2666aec99f4b5d996faa13c4aed7a3.html.
[29]玄怡,王茜,桑媛 . 医疗器械生产企业不良事件监测工作存在的问题及建议 [J]. 医疗装备,2023,36(12):23-25.
[30]王琪,唐楠,朱伯臣,等 . 高质量发展下我国医疗器械不良事件监测面临的挑战与思考 [J]. 中国食品药品监管,2023(6):108-117,142.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号