发布时间:2024-06-13 09:26:28 浏览 次
作者:苏建程
单位:北京市医疗器械检验研究院 (北京 101111)
〔关键词〕微生物屏障;稳定性;挑战;验证方案
〔中图分类号〕R197.39 〔文献标识码〕B
〔文章编号〕1002-2376(2024)08-0035-06
无菌医疗器械初包装的核心功能是防止环境中的微生物进入包装内部,密封完整的包装系统可为医疗器械提供一个安全可靠的环境,并在最终灭菌处理后持续保持内装物在使用前的无菌状态,所以医疗器械的初包装为微生物屏障系统。初包装系统的完整性至关重要,是灭菌医疗器械在生命周期内的安全性保障,所以其为无菌医疗器械的组件或附件 [1]。开发无菌医疗器械的初包装系统是一项复杂的工作,需综合考虑被包裹物的物理特性、预期的灭菌技术、产品的货架期限、存储条件、转运条件和启用条件等因素,实现包装系统的物流保护、灭菌适应、屏障微生物和无菌取用的预期功能 [2]。基于此,本研究探讨无菌医疗器械初包装系统的性能评价方法,为相关技术人员提供参考。
1 标准体系
国家药品监督管理局为加强医疗器械产品注册工作,发布了《医疗器械安全和性能的基本原则》(2020 年第 18 号通告),该文件将国家标准GB/T 19633.1-2015 《最终灭菌医疗器械包装 第 1 部分:材料、无菌屏障系统和包装系统的要求》(ISO11607-1:2006,IDT)列为关键的技术要求 [3]。因无菌医疗器械的初包装材料性能是影响无菌器械货架期寿命的关键要素,特别是不受时间因素影响器械有效性的无菌产品,其包装材料的微生物屏障性能为影响无菌器械安全性的唯一因素。GB/T 19633.1 标准规定了初包装材料、预成型初包装袋和已形成微生物屏障功能的初包装要求,用于验证应用的初包装系统是否符合稳定性研究的预期要求。应用 YY/T 0681《无菌医疗器械包装材料试验方法》系列标准开展项目测试 [4],可证明当前所用包装材料是否符合无菌器械产品的稳定性要求。该系列标准共由 18 部分组成,根据对初包装材料的测试项目意义,将其划分为 4 个类别(见表 1),开展评价工作时应依据包装材料的功能特性选择适宜的试验方法实施评价工作,确保评价结果的科学性。
表 1 YY/T 0681 系列标准的类别划分

2 性能评价
无菌医疗器械的初包装系统称为无菌屏障系统。评价无菌医疗器械初包装的重点工作是开展包装材料的阻菌性试验微生物屏障性能试验。已成型的初包装系统屏障性能受 2 个因素影响,一是原材料本身的屏障性能,二是成型后材料间的贴合面是否密闭。放行的成品在货架寿命期内受 2 种因素影响 [4-7],一是时间因素导致材料老化,二是事件因素导致应力冲击。遵循对初包装系统的风险因素分析,开展包装系统的屏障性能研究至少涵盖上述4 个评价类别。YY/T 0681 系列标准对同一类别的测试项目给出了多项试验方法,需根据初包装系统中所用材料的基本特性和包装的设计功能等因素选择试验方法,确保所应用的实验项目逻辑关系合理,见图 1。
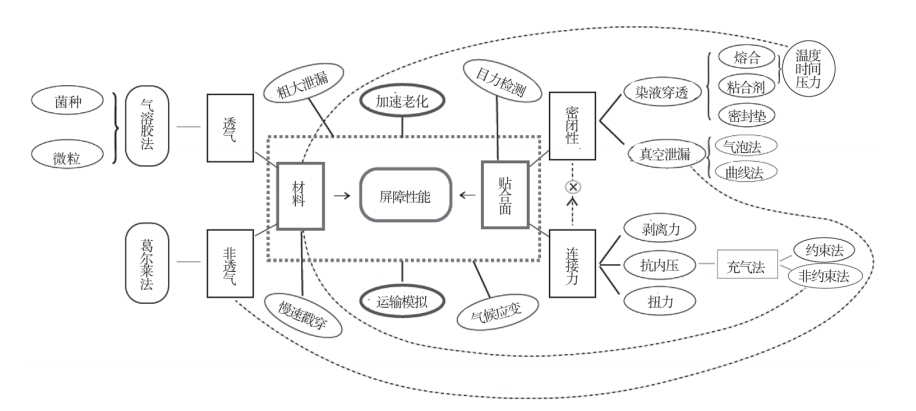
图 1 包装系统试验项目的逻辑关系
2.1 微生物屏障性能试验(阻菌性能试验)
初包装完整的器械在经受最终灭菌的处理或运输储存期间可能受环境中的气压变化而导致包装的内外形成压力差 [8],此时于材料的表面形成穿梭气流,向包装内流入的气流中可能夹带所处环境中的污染因子,评价污染因子能否被包装材料有效滤除的水平即包装材料的微生物屏障性能(阻菌性能)。YY/T 0681 系列标准中对该项目的评价提供了 4 种方法,仅适用于透气性初包装材料;对于非透气性初包装材料,利用葛尔莱法试验仪测试即在不少于 1 h 的时间内观察该试验材料,无泄漏迹象即可证实材料具备良好的微生物屏障能力。
验证透气性材料的试验方法依据试验原理可分为气溶胶法和接触法,依据试验结果可分为定量法和定性法 [9-10],见表 2。结合无菌医疗器械的风险控制水平认为,应用气溶胶法开展初包装材料的屏障性能验证更合理、更精准。相比接触法,气溶胶法能更有效利用气流效应对试验材料进行分析,充分模拟透气性材料的最不利工况场景,模拟透气材料较高的预期使用风险;相比接触法的试验结果,气溶胶法的结果可精确计数,利用气溶胶的本底浓度精准定量被测样品的屏障效率。图 2 为 1 组微生物气溶胶法的试验结果,相比粒子计数法的表象特性,该方法能够提供更佳的客观现象。
表 2 微生物屏障试验方法的类别


图 2 微生物屏障结果
2.2 密封性能试验
影响初包装系统屏障性能的另一关键要素是初包装材料间的连接密闭性,如材料间的搭接不完整或包装封口不完整,均可成为污染因子进入初包装系统内部的通道 [11],导致医疗器械的无菌性失效。“连接强度”≠“连接密闭”,仅评价包装系统的密封强度是不科学的。初包装系统中存在微小泄漏迹象仅能通过“染液穿透”“真空泄漏”和“粗大泄漏”的试验程序才能识别出。连接强度是为控制已密封良好的初包装系统在货架期内受到可预期的材料老化、运输震动、意外跌落和环境低气压等干扰因素影响时,不会导致密封性能失效。
2.3 老化模拟试验
加速老化方法提供了一种适宜的模拟程序,让测试者可以优于实时老化的时间内得到受时间因素影响的预期样品。但模拟老化样品可能会与实际老化样品存在差异,所以对包装系统的研究必须同步关注实时老化的样品检测数据,再评价模拟老化的验证结论风险是否可接受。老化是包装材料不可避免的一种挑战,可导致材料的物理性能、化学性能等发生偏移,所以应对老化后的初包装系统的微生物屏障性能、连接强度、密闭性等开展必要的评价工作。表 3 为初包装材料在不同老化时间点开展的微生物屏障性能测试数据。
表 3 材料在不同老化时间点的微生物屏障数据
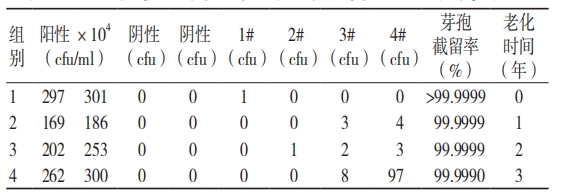
注:表中的老化时间为模拟 3 年时长,加速老化过程中每满1 年时长开展 1 次阶段性测试,所以老化期内共计 3 个时间结点,0 年为初始状态的样品,最终获得 4 组数据用于趋势风险分析
2.4 运输模拟试验
利用运输模拟试验可预测包装系统因事件因素导致的挑战,外包装箱直接承受运输环境中的风险挑战,为初包装系统提供安全防护,所以评价运输试验的结果为检验内装物是否完好。仅用初包装系统的外观完好性作为评价运输模拟实验的唯一结论是片面的。因初包装系统的密封完整性可能会受模拟运输的加载力产生冲击、震动和低气压等危险源挑战出现微观的泄漏迹象,不完整的密封界面将导致初包装系统的微生物屏障性能失效,所以在运输模拟程序后进一步评价初包装系统中是否存在微小的泄漏迹象极其重要。目力检测的检出限与测试技术相比有极大的量差,可导致结论有质的差异,利用染液穿透、真空泄漏和粗大泄漏测试技术是必要的。
3 密封过程控制
无菌医疗器械的初包装材料通常应用热封技术形成初包装屏障系统。初包装的热封工序是无菌医疗器械生产过程中的特殊工序。作为无菌医疗器械生产过程中的末道工序的关键过程,封口工序的稳定性影响成品器械的出厂状态。形成密封界面的热封参数过低可能会在密封界面处形成泄漏通道,有害因子会通过界面的欠封进入初包装系统内,危害无菌医疗器械的使用安全;过高的热封参数又会导致初包装材料使用中发生内聚性破坏、粘连性破坏、材料断裂等过封情形 [12],见图 3。

图 3 过封情形
热封工序的 3 要素是温度、时间与压力 [13],热封过程的控制由包装材料和包装设备共同决定,设计验证方案时均应充分考虑。在开展模拟研究工作中,控制试验过程中的环境、人员、设备、程序和材料相对一致是保证试验结果的基础 [14]。
3.1 包装材料
仪器设备:热封试验仪、电子拉力试验机。密封形式:翼式密封,封口深度 10 mm。热封参数:利用预设的参数点排列组合出 36 份不同的热封条件制备样品。温度点(150、160、170、180 ℃),压力点(210、310、410 kPa),时间点(2、3、4 s)。裁样要求:每份热封样品中均匀裁切为 8 个(15 mm ×40 mm)试样。
测试方法:保持试样的夹持状态一致,以200 mm/min 的速度拉伸,统计 8 个试样的均值代表每份样品的剥离强度。
3.1.1 温度对密封强度的影响
选取热封的时间和压力相同的测试数据建组,利用 4 组数据进行平行对照,见表 4。
表 4 温度为变量的试验数据
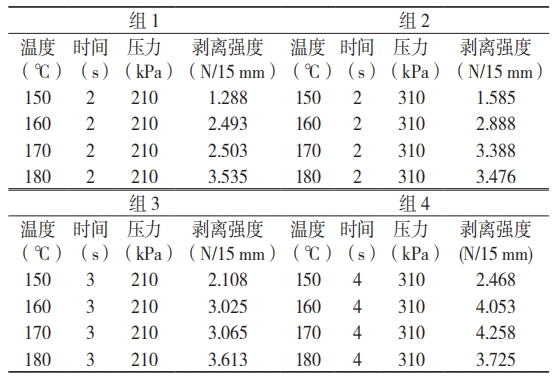
将表 4 数据作曲线图(图 4)分析,其中组 2 数据的曲线形态相对最佳,说明在此组条件下的热封温度与密封强度成理想的正线性关系。
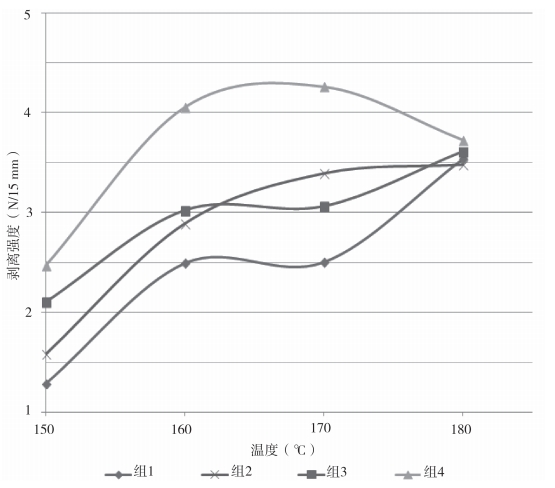
图 4 温度为变量试验数据的曲线图
3.1.2 压力对密封强度的影响
选取热封的温度和时间相同的测试数据建组,对 4 组数据进行平行对照,见表 5。
表 5 压力为变量的试验数据
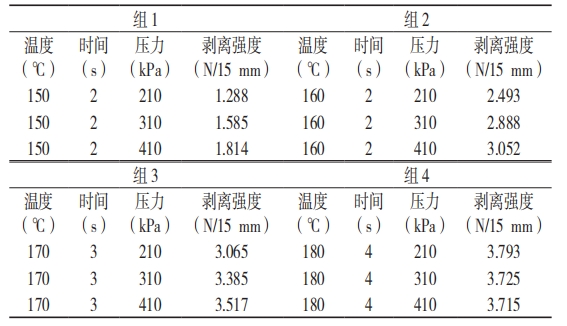
将表 5 数据作曲线图(图 5)分析,其中 3 种模拟条件中该包装材料的热封压力与密封强度表现出正线性关系,组 4 数据的表现异常,说明在此组条件下的热封压力对密封强度无利。
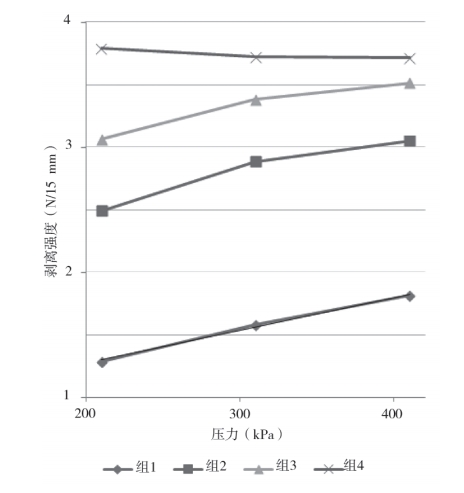
图 5 压力为变量试验数据的曲线图
3.1.3 时间对密封强度的影响
选取热封的温度和压力相同的测试数据建组,利用 4 组数据做平行对照,见表 6。
表 6 时间为变量的试验数据
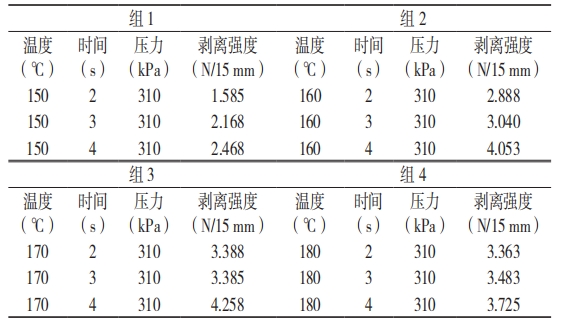
将表 6 数据作曲线图(图 6)分析,4 种模拟条件中组 2 与组 3 条件下该包装材料的热封时间与密封强度均表现出较佳的正线性关系。
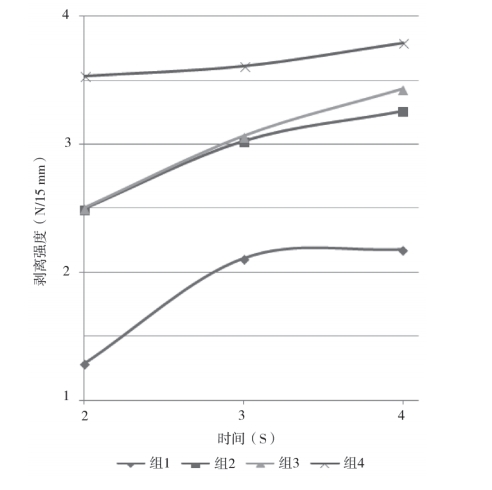
图 6 时间为变量试验数据的曲线图
综合温度、压力、时间 3 项变量的数据结果分析,组间的数据交汇点为温度 160 ~ 170℃,时间 2 s,压力 310 kPa,为当前模拟材料的工艺研究输出参数。
3.2 热封设备
通过对 1 条热封边连续裁样测试,可对热封设备的封口性能实施评价。利用 2 种软性包装材料热封后的剥离强度数据(见表 7),模拟评价实验室内的热封设备对材料的适用水平。分析模拟用材料在 A、B、C 不同热封参数下的复现数据,发现试验组 1 材料结果的组间数据精密度极差,证明热封设备对此包装材料的稳定性较好;试验组 2 材料结果的组间数据精密度极差大,但组内数据的精密度更高,证明热封设备对此包装材料的适用性较好。
表 7 热封设备对不同材料的验证数据
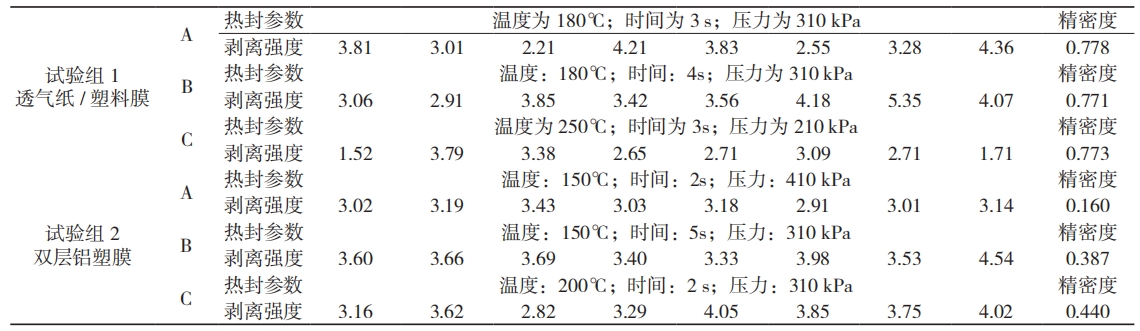
裁样占比率 P 直接影响评价结论的置信度,试验组 1 为 51.1%,试验组 2 为 79.5%,公式如下:
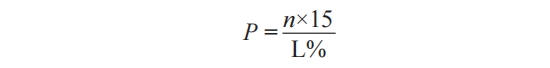
式中:N 为裁样数量 ,15 为裁样宽度,L 为热封边长。
一次封边内的多个试样间的数据精密度可反映出热封设备对加工材料的适用性,裁样的占比率与评价结果的准确度呈正相关。综合测试数据的精密度和置信水平,结论为当前热封设备更适用于试验组 2 的模拟材料。
4 预成型包装材料的评价
预制包装袋是初包装材料的主要型式 [15],在内包工序前已完成部分封边,所以 1 份完整的无菌医疗器械初包装系统中的封边存在多次热封情形。实验室内对 5 份不同企业的包装样品进行测试,通过热封印痕确认同一初包装上的不同次热封边,每次封边中分别取 10 个试样测量密封强度,见表 8。
表 8 试样的密封强度
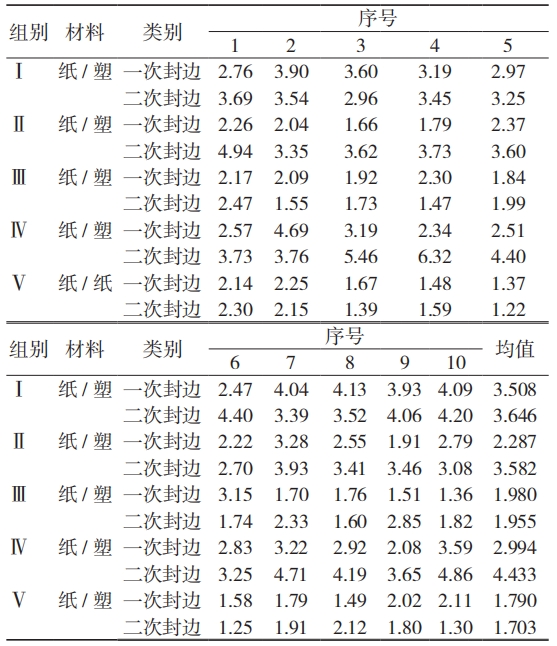
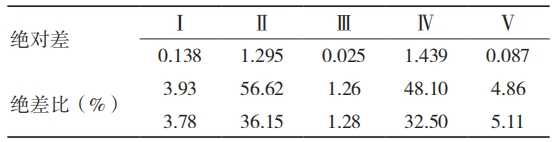
当 1 份初包装单元中的封边强度差异较大时可潜在危害到初包装系统的屏障性能。通过评价试验组内数据均值的绝对差与绝差比(绝对差比均值)可表现为 1 份初包装材料性能,结果发现Ⅱ组与Ⅳ组的样品数据差异较大,见表 9。原材料中已预制的密封边性能对初包装系统的影响是不可分割的,应避免“木桶效应”导致的初包装系统缺陷。
表 9 数据表 8 的分析结果
5 讨论
YY/T 0681 系列标准作为验证无菌医疗器械初包装系统的技术要求,为实验者提供了程序化的试验方法。无菌医疗器械初包装系统的核心功能体现在对微生物的屏障能力,包装材料和密封连接共同决定着初包装系统的形成结果,在选择评价项目时应充分识别包装材料的基本特性。例如透气材料与非透气材料的本质差异是气流效应,因此初包装系统在应用透气性材料时就不适用“低气压”和“真空泄漏”试验方法。经模拟老化程序处理的初包装系统,对样品的风险识别不应仅限于包装系统的材料表面,其密封界面处易因材料老化导致密封强度发生偏移,产生的间隙可能会形成泄漏通道;经模拟运输程序处理的初包装系统,对样品的风险识别不应仅限于包装系统的密封界面,其材料表面易因应力冲击造成粗大泄漏点,成为屏障系统的泄漏缺陷。
热封过程作为无菌医疗器械生产工艺中的特殊工序,能否连续生产出密闭的初包装直接影响到无菌产品的使用安全,验证其过程控制的可靠性极为关键,完整的验证结论中应充分体现材料受热封参数的变量响应。特别是含预成型封边的初包装系统,仅评价包装系统的末道封边是不充分的,应开展预成型部分的封边研究。
【参考文献】
[1]中华人民共和国国家质量监督检验检疫总局 . 最终灭菌医疗器械包装 第1部分 : 材料、无菌屏障系统和包装系统的要求 :GB/T 19633.1-2015[S]. 北京:中国标准出版社,2015.
[2]中华人民共和国国家质量监督检验检疫总局 . 最终灭菌医疗器械包装 第2 部分 : 成形、密封和装配过程的确认的要求 :GB/T 19633.2-2015[S]. 北京:中国标准出版社,2015.
[3]国家药品监督管理局医疗器械技术审评中心 . 国家药监局器审中心关于发布医疗器械安全和性能基本原则符合性技术指南的通告:2022年第29 号 .[EB/OL]. (2022-07-12 )https://www.cmde.org.cn//xwdt/shpgzgg/gztg/20220713165731131.html.
[4]国家药品监督管理局 . 医疗器械软性初包装设计与评价指南:YY/T 1759-2020[S]. 北京:中国标准出版社,2020.
[5]国家食品药品监督管理局 . 无菌医疗器械包装试验方法 第10 部分:透气包装材料微生物屏障分等试验:YY/T 0681.10-2011[S]. 北京:中国标准出版社,2011.
[6]国家食品药品监督管理局 . 无菌医疗器械包装试验方法 第4部分:染色液穿透法测定透气包装的密封泄漏 :YY/T 0681.4-2010[S]. 北京:中国标准出版社, 2010.
[7]国家药品监督管理局 . 无菌医疗器械包装试验方法第1部分:加速老化试验指南:YY/T 0681.1-2018[S].北京:中国标准出版社,2018.
[8]国家药品监督管理局 . 无菌医疗器械包装试验方法 第15 部分:运输容器和系统的性能试验:YY/T 0681.15-2019[S]. 北京:中国标准出版社,2019.
[9]国家食品药品监督管理局 . 无菌医疗器械包装试验方法 第3部分:无约束包装抗内压破坏:YY/T 0681.3-2010[S]. 北京:中国标准出版社,2010.
[10]国家药品监督管理局 . 无菌医疗器械包装试验方法 第17部分:透气包装材料气溶胶过滤法微生物屏障试验:YY/T 0681.17-2019[S]. 北京:中国标准出版社,2019.
[11]无菌医疗器械包装试验方法 第14部分:透气包装材料湿性和干性微生物屏障试验:YY/T 0681.14-2018[S]. 北京:中国标准出版社,2018.
[12]国家药品监督管理局 . 无菌医疗器械包装试验方法第 4部分:染色液穿透法测定透气包装的密封泄漏:YY/T 0681.4-2021[S]. 北京:中国标准出版社,2021.
[13]国家食品药品监督管理局 . 无菌医疗器械包装试验方法 第2 部分:软性屏障材料的密封强度:YY/T 0681.2-2010[S]. 北京:中国标准出版社,2010.
[14]国家食品药品监督管理局 . 最终灭菌医疗器械包装材料 . 第10 部分:可密封组合袋、卷材和盖材生产用涂胶聚烯烃非织造布材料要求和试验方法:YY/T 0698.10-2009[S]. 北京:中国标准出版社,2009.
[15]国家食品药品监督管理局 . 最终灭菌医疗器械包装材料 . 第5 部分:透气材料与塑料膜组成的可密封组合袋和卷材 . 要求和试验方法:YY/T 0698.5-2009[S]. 北京:中国标准出版社,2009.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号