发布时间:2023-03-17 09:39:37 浏览 次
作者:钟小群(通信作者),李忠贵,袁海铭
单位:江西省医疗器械检测中心
〔关键词〕医疗器械;使用质量;上市后监管;使用环节;法律法规
〔中图分类号〕R197.39 〔文献标识码〕A
〔文章编号〕1002-2376(2023)05-0027-05
基金项目:江西省药品监督管理局科研项目(2019JS22、 2019JS3522)
随着科学的进步、人民对健康生活的美好追求,医疗器械产品种类层出不穷,新技术、新产品、新业态、新模式不断涌现,生产技术、检验方法、维修手段、人工智能的迭代日新月异,如何认识、评价、监管这些品种数量日益增加、风险程度及发生频度不断提高的医疗器械,考量着政府相关管理部门,特别是药品监管部门的能力和水平。《医疗器械管理条例》[1](以下简称《条例》)是医疗器械监管的基础,明确了医疗器械是需要全生命周期监管的产品,上市前相对严格的注册或备案要求可在一定程度上控制产品风险,而上市后特别是使用过程是发生风险并产生实质危害的环节,需要制定严格的管理要求[1-3],然而具体实施差异较大,主要原因包括:上市后产品的监管涉及多个监管部门,比如药品监管部门及卫生主管部门,前者对产品质量进行监管,后者对使用行为进行监管、监测及评价[1];产品种类繁多、性能差异大,难以制定统一的技术标准规范[4],需要较强的专业能力及监管资源;产品质量不仅与生产质量有关,而且与临床使用人员的操作水平,产品的存放条件、维护保养、维修后效能评价等因素密切相关,责任划分复杂,容易推诿;检验机构在线检测技术及能力有限,难以覆盖大部分临床使用器械等。为此,本研究梳理了医疗器械使用环节质量、在用状态与其上市后监管之间的关系,对辖区内相关机构进行调查研究,分析当前监管现状,并提出科学监管要求,为相关制度的完善提出建议。
1 医疗器械使用环节质量、在用状态与其上市后监管的关系
梳理我国医疗器械产品质量相关法规、规章和规范性文件发现,《中华人民共和国产品质量法》《中华人民共和国计量法》《中华人民共和国特种设备安全法》均无医疗器械的定义,只有对“产品”的通用要求,这些法律是医疗器械的上位法,必须遵守;《医疗器械管理条例》(以下简称《条例》)对医疗器械有明确的定义和适用范围,是医疗器械管理的基本要求;而“在用医疗器械”在《条例》《医疗器械使用质量监督管理办法》《医疗器械临床使用管理办法》中均有出现,但并无定义,在《国家食品药品安全“十一五”规划》《国家药品安全“十二五”规划》《“十三五”国家药品安全规划》存在“在用医疗器械”相关的管理要求,但是随着各项法规的完善,监管主体发生了变化,《“十四五”国家药品安全及促进高质量发展规划》中却未涉及“在用医疗器械”,相关法规及涉及内容见表1。对“在用医疗器械”文献报道数量及内容体现了国家“十一五”至“十三五”的任务要求,早在2007年,闻宜[5]报道了中国医学科学院、协和医科大学“在用医疗器械风险管理问题及对策研究”论文答辩会的相关资讯,与会专家对这个选题的新颖性予以了肯定,自此拉开了对“在用医疗器械”研究的序幕,以“在用医疗器械”为关键词搜索知网,逐一查阅,查找其定义(见表2),均为自主定义,虽有差异,但是均与使用单位、使用环节关联。另外,在美国FDA官网及澳大利亚TGA(Therapeutic Goods Administration)官网搜索相关关键词,均未查到明确概念,均属于上市后监管(post-market)的范畴,因此本研究认为,“在用医疗器械”(medical devices used in health care facilities)[15]不是指某一类器械,而是指器械的一个生命周期,即使用单位正在使用的医疗器械总称,是风险产生的主要环节,需要科学的监管要求,对药品监督部门来说属于上市后监管。
表 1 医疗器械 / 在用医疗器械相关法规及内容


表 2 文献报道对在用医疗器械的定义

2 在用医疗器械监督管理现状
2.1 法规要求
自2000年1月4日《条例》发布以来,经过2次修订,现行版围绕鼓励创新发展、全生命周期质量监管要求,对医疗器械的注册与备案、生产、经营与使用等作出了全面规定,省级药品监督管理部门的监管内容亦有规定[1,16]。
2.2 标准要求
为应对医疗器械产业和监管的共同挑战,YY/T0287-2017《医疗器械 质量管理体系 用于法规的要求》[17]标准正式发布,该标准将生命周期定义为从初始概念到最终停用和处置的所有阶段;将上市后监督定义为收集和分析从已上市医疗器械中得到经验的系统过程;明确相关组织或单位均可参照此标准进行设计和开发、生产、储存和流通、安装、服务和最终停用及处置。
2.3 上市后监管现状
上市后监管是全生命周期监管的关键环节,体现产品风险收益、实现预期目的;及时发现使用过程中出现的不良事件、促进企业整改,以进一步提高产品的安全性和有效性或开发新产品[18]。国家药品监督管理局非常重视,成立了生产、经营、使用质量、网络销售、监督抽检、不良事件监测评价、案件查办7个上市后监管的法规制度研究工作组,使用质量监管尚处于研究阶段[19]。广东省药品监督管理局[20-21]在开展《广东省在用医疗器械监督管理条例》立法公开征求意见工作中,对外公开征求“在用医疗器械产品的范围、对在用医疗器械进行检测的适用标准,监管方式等的建议或意见”,征集期间只收到4条公众留言且未正式发布。有研究[22]对《在用医疗器械检验技术要求》的编制提出了构想,拟解决使用环节医疗器械在线检测这一国际难题,但目前尚未见该技术要求出台。
2.4 使用行为监督现状
国家卫生健康委员会于2021年1月12日发布了《医疗器械临床使用管理办法》,同年5月10日成立了国家医疗器械临床使用专家委员会,确定了第一届专家委员会名单及主要职责,明确了省级卫生健康委应成立或委托相关组织、机构,负责本行政区域内医疗器械临床使用监测、评价等工作;明确了县级以上地方卫生健康主管部门应加强监管,并组织定期或不定期抽查[23-24]。
2.5 在线检测现状
我单位为医疗器械检测机构,自2014年起,参与3年在用医疗设备抽检,2017—2021年独立进行在用医疗设备抽检,对辖区内医疗机构在用医疗器械进行在线监测,监测能力得到较大提升[25]。
3 使用情况调查
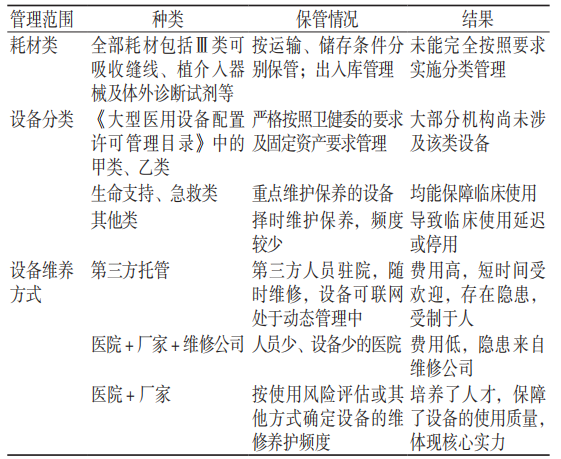
我单位是江西省内唯一一家医疗器械检测机构,对于生产、经营企业及医疗机构,以及产品上市后的管理状态有一定的了解。另外,本研究深入调研了30家医疗机构设备类管理部门,结果显示,只有1家机构尝试采用风险管理的方法自行监测生命支撑类、急救类医疗器械的日常使用、保养和维护;1家机构采用托管的方式,以每年近400万元的费用维护、维养该院的医疗设备,受到了一致好评。共性结果见表3。
表 3 江西省医疗器械使用情况调查表
4 科学监管建议
监管与发展是一对矛盾,必须两手抓,还要切实为企业提供便利,促进产业高质量发展。科学的监管可对行业健康发展起到至关重要的作用[29-34],因此既要放得好,又能管得住,坚守“四个最严”原则,融入“放管服”理念。
4.1 建立高效的沟通路径
除了挂职或驻厂锻炼等现场沟通路径,随着互联网的普及,以及疫情防控的需要,日益便利的在线会议、微信群、QQ群的使用,有助于建立高效的多维沟通路径,这些路径使监管前移到研发阶段,通过正确的政策解读及专家指导,培养了监管人才,也帮助技术人员了解了法规及监管要求,主动完善医疗器械的生产、经营和使用条件,最大限度地保障医疗器械的质量。产品上市后通过品种回顾,有序检查、审查等手段,形成了以医疗器械质量为抓手的可持续监管通道,同时体现出监管的服务能力及水平。
4.2 勇于尝试新监管方法
监管人员不断学习中医器械、人工智能医疗器械、高端医疗器械、创新生物材料等领域所需的专业知识,面对新型产品的监管需求,敢于尝试新方法、新工具,促使创新产品安全有效地服务于临床需求。
4.3 尝试新措施
(1)对企业信用进行分级管理:除了践行职业检查员制度外,还要参照《国务院关于建立完善守信联合激励和失信联合惩戒制度加快推进社会诚信建设的指导意见》[35]《江西省人民政府办公厅关于推进企业信用监管制度改革的意见》[36]中企业信用信息的归集范围,对企业信用进行分级管理,对守信(信用高)、基本守信(有信用)企业以合规服务、风险提示及质量提升建议为主,对失信(应用等级比较低)企业、严重失信(多次失信或有严重不良记录)企业建立惩戒与淘汰机制,使有限的监管资源得到最佳利用。(2)鼓励企业加入行业协会或专业学会:充分发挥协会各项服务能力,如政策法规咨询、优化资源配置,组织企业参与标准制修订、技术创新、提高质量管理等活动,促进行业自律,引导企业树立底线意识、风险意识、合规意识,增强监管的服务性和有效性。(3)寓监管于服务:通过政策引导和优化服务,建立“政产学研用”协同创新机制,鼓励并支持企业将新科技转化为新产品,提升市场竞争力。(4)优化不良事件报告流程及报告内容:鼓励使用机构(或人)可疑就报,鼓励不良事件监测技术机构定期向使用单位以公函的形式发布医疗器械安全性有关问题;督促企业建立不良事件监测体系,鼓励企业在产品小包装上标注生产地不良事件监测机构的联系方式。(5)督促企业建立上市后管理体系:明确使用期限、维护保养的频度、质控检测指标、退市处理方法等,鼓励企业积极收集医疗器械使用过程中的性能和安全性数据,并进行科学分析,以获得真实的器械效能与时间函数[27],保障器械整个生命周期的质量[1,37]。(6)探索上市后医疗器械目录的管理:在风险分类管理的基础上,探索上市后器械目录管理,分为无菌性一次性使用、植入材料和人工器官类、体外诊断试剂类、角膜接触镜类、防护类、仪器设备类、可重复使用类、可家用类等;根据实际情况以目录形式实施风险管理,符合当今科学监管的趋势,可以提高监管效率。
【参考文献】
[1]中华人民共和国国务院令(第739 号). 医疗器械管理条例 [EB/OL].(2021-02-09)[2022-10-21].http://www.gov.cn/zhengce/content/2021-03/18/content_5593739.htm.
[2]谢松城,郑焜 . 医疗设备使用安全风险管理 [M]. 北京:化学工业出版社,2019 :129-188.
[3]国家药品监督管理局医疗器械技术审评中心 . 美国医疗器械管理法规(二)[M]. 北京:中国医药科技出版社,2019 :388-404.
[4]陶立波 . 医械带量集采:质量监管是重要保障 [N]. 医药经济报,2021-10-18(F2).
[5]闻宜 . 通过预防性措施加强器械使用安全 [J]. 中国医疗器械信息,2007,13(6):78.
[6]张欣涛,郝擎,石现,等 . 在用医疗器械产品质量监管初探 [J]. 中国医疗器械杂志,2014,38(3):207-209.[7]
潘寰 . 我国在用医疗器械安全监管法律主体研究 [J].中南林业科技大学学报(社会科学版),2014,8(2):109-112.[8]
余冬,梁灏方 . 在用医疗器械现状分析与建议 [J]. 医疗卫生装备,2013,34(5):101-103.
[9]郑彦云,李丹荣,胡正路 . 关于构建在用医疗器械监管体系的几点思考 [J]. 中国医疗器械信息,2012(10):30-35.
[10]欧阳昭连,池慧 . 国内外在用医疗器械风险管理问题初探 [J]. 中国医疗器械信息,2007,13(4):42-47.
[11]欧阳昭连.在用医疗器械风险管理问题及对策研究 [D].北京:中国协和医科大学,2007.
[12]潘寰 . 在用医疗器械安全监管的法律规制研究 [D].湘潭:湘潭大学 2014.
[13]喻洪流,钱三省 . 医疗器械的全寿命质量与安全监管模式探讨 [J]. 中国医疗器械杂志,2006,30(2):120-122,133.
[14]王辉,刘立科,张成,等 . 关于现阶段区域性在用医疗器械质量监督的探讨 [J]. 生物医学工程学进展,2017,38(3):185-188.
[15]FDA.Letters to Health Care Providers[EB/OL].(2022-03-21)[2022-10-21]. https://www.fda.gov/medicaldevices/medical-device-safety/letters-health-careproviders).
[16]国家药品监督管理总局 . 国家药监局关于学习宣传贯彻《医疗器械监督管理条例》的通知(国药监法〔2021〕19号)[EB/OL].(2021-03-18 )[2022-10-21].https://www.nmpa.gov.cn/xxgk/fgwj/gzwj/gzwjylqx/20210318173224192.html.
[17]国家食品药品监督管理局 . YY/T 0287-2017医疗器械质量管理体系 用于法规的要求 [S]. 北京:中国标准出版社,2017.
[18]滕颖影,李柴全,胥洋,等 . 真实世界数据在医疗器械上市后监测中的应用进展 [J] . 中国药物警戒,2022,19(3):233-238,243.
[19]国家药品监督管理局 . 医疗器械上市后监管法规制度研究推 进 会召开 [EB/OL].(2021-12-15)[2022-10-21].https://www.nmpa.gov.cn/yaowen/ypjgyw/hyxx/20211215193918154.html.
[20]广东省药品监督管理局 . 关于《广东省在用医疗器械监督管理条例》立法公开征求意见的公告 [EB/OL].(2020-12-15)[2022-10-21]. http://mpa.gd.gov.cn/xwdt/tzgg/content/post_3150806.html.
[21]广东省药品监督管理局 .关于《广东省在用医疗器械监督管理条例》立法公开征求意见的结果反馈 [EB/OL].[2020-12-31].http://mpa.gd.gov.cn/gzcy/zjyj/content/post_3166796.html.
[22]杨振.我国 《在用医疗器械检验技术要求》编制构想[J].中国药事,2016,30(1):54-58.
[23]医政医管局 . 国家卫生健康委办公厅关于成立国家医疗器械临床使用专家委员会的通知(国卫办医函﹝2021﹞254号)[EB/OL].(2021-04-30 )[2022-10-21].http://www.nhc.gov.cn/yzygj/s7658/202105/60308b2daa6340ba9c9e97c361d236e8.shtml.
[24]国家卫生健康委员会法规司 .《医疗器械临床使用管理办法》解读 [EB/OL].(2021-02-04)[2022-10-21].http://www.nhc.gov.cn/fzs/s3578/202102/41ad215b1783470a94074b3d6a0aa0f9.shtml.
[25]刘小辉,冯琪,王新华,等 . 江西省医疗器械监督抽检工作现状及对策研究 [J]. 中国食品药品监管,2022(1):68-73.
[26]国产医疗设备应用示范创新售后服务体系研究课题组,浙江省医师协会临床工程师分会 . 医疗设备质控检测与预防性维护专家共识 [J]. 中国医疗设备,2021,36(2):1-3.
[27]李澍,王权,张艳丽,等 . 在用医疗器械的检验技术要求 [J]. 中国医疗设备,2014,29(10):58-61.
[28]李静莉,郑佳,余新华,等 . 在用医疗器械科学监管的形势分析与建议 [J]. 中国医疗设备,2015,3(1):68-70.
[29]吴颖 . 监管科学助力科学监管 [J]. 上海医药,2022,43(11):1-2.
[30]沙明泉,李楠楠,夏文静 . 美国 FDA 监管科学研究进展及启示 [J]. 中国药物警戒2022,19(10):1055-1059.
[31]毛振宾,闫金定,张雅娟 . 监管科学重点实验室建设与发展的思考 [J]. 中国药事,2022,36(9):967-972.
[32]苏明,苏紫媚,向丽烜,等 . 浅谈医疗器械的科学监管 [J]. 中国医疗器械信息,2021,27(21):1-2,22.
[33]倪泰 . 运用科学监管助推医药创新发展——专访湖南省药品监督管理局党组书记梁毅恒 [N]. 中国市场监管报,2021-11-2(4).
[34]李安渝,童晓渝 . 医疗器械监管科学发展和路径研究 [J]. 中国食品药品监管,2021(7):33.
[35]国务院 . 国务院关于建立完善守信联合激励和失信联合惩戒制度加快推进社会诚信建设的指导意见( 国 发〔2016〕33号)[EB/OL].(2016/05/30)[2022-10-21]http://www.gov.cn/zhengce/content/2016-06/12/content_5081222.htm.
[36]江西省市场监督管理局(知识产权局). 江西省人民政府办公厅关于推进企业信用监管制度改革的意见(赣府厅发 〔2017〕92 号)[EB/OL].(2017/10/27)[2022-10-21].http://amr.jiangxi.gov.cn/art/2019/11/14/art_26963_827779.html.
[37]国家药品监督管理局医疗器械技术审评中心 . 欧盟医疗器械管理法规 [M]. 北京:中国医药科技出版社,2020 :148-168.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号