发布时间:2024-02-27 10:06:37 浏览 次
作者:叶姣,宾芳,鲁波,蔡泽润,胡玲(通信作者)
单位:湘潭市中心医院 (湖南湘潭 411100)
〔关键词〕影像组学;脑胶质瘤;机器学习
〔中图分类号〕R737.33 〔文献标识码〕B
〔文章编号〕1002-2376(2024)01-0025-04
脑胶质瘤是常见的脑部原发性肿瘤,世界卫生组织将其分为Ⅰ ~ Ⅳ级,其中Ⅰ级和Ⅱ级为低级别脑胶质瘤(low-grade gliomas,LGGs),Ⅲ级和 Ⅳ 级 为 高 级 别 脑胶 质 瘤(high-grade gliomas,HGGs)[1]。研究证实,不同级别的脑胶质瘤患者的治疗方法和预后差异较大。手术切除为 LGGs 的首选治疗方法,化疗和辅助放疗是 HGGs 治疗的必要方法 [2-3]。研究表明,脑胶质瘤分级级别越高,术后复发率越高,患者生存率越低 [4]。MRI 是诊断脑胶质瘤的常用方法,其具有软组织对比度高等优点,但其诊断精度仍有待提高 [5]。近年来,影像组学方法已广泛应用于癌症的诊断分级、疗效评估及生存期进展预测等领域,为脑胶质瘤的分级提供了思路 [6-10]。本研究拟提取脑胶质瘤多模态 MRI 的影像组学特征,并对其特征进行分析,旨在建立 3 种机器学模型,以提高脑胶质瘤分级的精度。
1 资料与方法
1.1 数据获取及预处理
本研究采取公开可获取的 BraTS2018 训练数据集作为研究资料,其包括 T1、T2、T1ce、Flair 4 个序列 MRI 图像及增强肿瘤区域、浮肿和坏疽 3 个区域的掩膜文件。本研究仅采用增强肿瘤区域作为感兴趣区域(regions of interest,ROI),用于后续影像组学特征的提取。将 4 个序列的 MRI 三维体素间距插值为 1 mm×1 mm×1 mm,调整每个序列图像大小为 240×240×155,并使用 Z-score 方法进行标准化处理。经处理后,数据集包括脑胶质瘤258 例,其中高分化脑胶质瘤 210 例,低分化脑胶质瘤 48 例,依据 9‥1 的比例分配为训练集 233 例和测试集 25 例。
1.2 影像组学特征提取
影像组学特征提取是指从 ROI 中计算大量特定参数的过程。采用基于 Python 3.7 平台的 Pyradiomics 开源包提取脑胶质瘤影像组学特征。提取的影像组学特征包括一阶及 3 类。一阶统计特征反映所测 ROI 的对称性、均匀性及局部强度分布变化;形状定量描述 ROI 的三维大小和形态信息;纹理特征反映了 ROI灰度间的空间排列关系。每个模态 MRI 影像均提取107 个影像组学特征,共提取 428 个影像组学特征。
1.3 特征筛选及模型建立
首先,对所有特征进行最大最小标准化处理,使标准化后的特征数值处于(0,1)。其次,使用Spearman 系数计算特征间的相关性,并保留任意2 个特征间相关系数 > 0.9。使用 LASSO 算法筛选最终用于构建影像组学模型的特征,根据权值 λ 调整 LASSO 回归复杂度,λ 值越大,对变量较多的线性模型惩罚力度越大。训练集进行 10 倍交叉验证,找到交叉验证误差最小的 λ 值,筛选出 λ 值不为 0 的特征,并计算特征权重,将最后得到 21 个特征组成的融合子集作为后续分类模型的基础。
1.4 机器学习分类模型
完成特征筛选后,构建 3 种机器学习分类模型:对数几率回归(Logistic regression,LR)、支持向量 机(support vector machine,SVM) 和 多 层 感 知机(multi-layer preceptron,MLP)。LR 是一种线性模型,通过线性决策边界将数据分成 2 类。SVM是一种非线性模型,其使用核函数将数据映射至高维空间,并使用线性决策边界分离数据。MLP 是一种深度学习模型,其由多个神经元层组成,并在神经元层后添加激活函数,使 MLP 可用于非线性分类任务中。所有模型均采用网格搜索方法进行训练,对各类模型予必要的参数调整,得到训练集各分类模型的最佳参数。
1.5 统计学处理
采用 Python 3.7 对数据进行统计分析。计算各预测模型脑胶质瘤高低分化的准确率、曲线下面积(area under curve,AUC)、灵敏度、特异度,并绘制采用受试者特征曲线(receiver operating characteristic curve,ROC)与决策曲线(decision curve analysis,DCA)评估预测模型效能。
2 结果
2.1 特征选择
使用斯皮尔曼相关系数去除冗余特征后筛选出 136 个特征,使用 LASSO 算法筛选最终用于构建影像组学模型的特征,见图 1。最佳惩罚系数λ = 0.0168。经选择后,最终保留 22 个系数值不为 0 的特征,用于机器学习模型的训练测试,各特征权重见图 2。
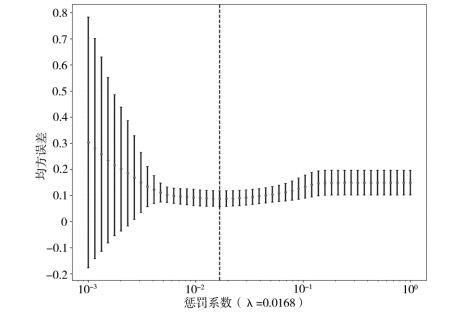
图 1 10 倍交叉验证选择最佳惩罚系数 λ
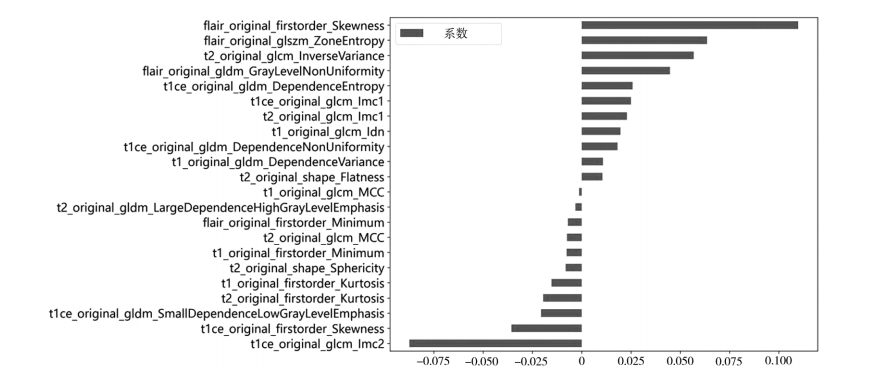
图 2 筛选出影像组学特征权重
2.2 模型分类结果
表 1 为 LR、SVM、MLP 3 种机器学习算法构建影像组学模型预测脑胶质瘤高低分化的结果。图 3为 3 种模型下训练集和验证集的 ROC 曲线。所有模型在训练集的 AUC 均 >0.95,测试集的AUC均 >0.90。LR 在 测 试 集 中 的 准 确 率、AUC 和特异度均为最高,敏感度低于 SVM 模型。图 4 为 3 种模型下的 DCA 曲线。DCA 曲线表明,3 个模型均具有较好的临床收益,但 LR 的净收益高于 SVM 和MLP,因此,在影像组学模型中,LR 为最优预测模型。
表 1 影像组学模型预测脑胶质瘤高低分化的结果
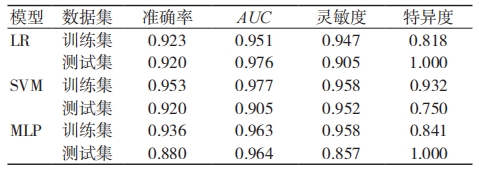
注:LR 为对数几率回归,SVM 为支持向量机,MLP 为多层感知机,AUC 为曲线下面积
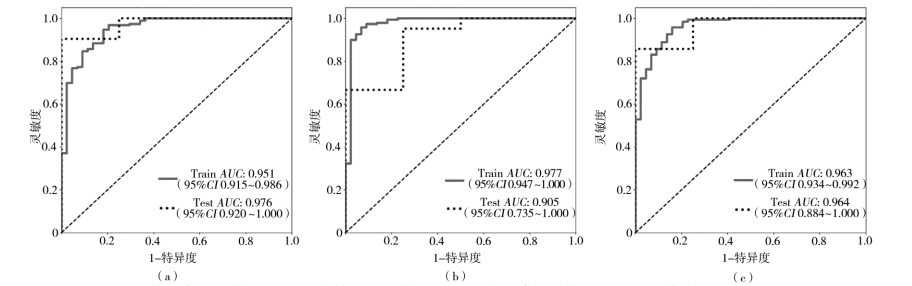
注:(a)对数几率回归模型,(b)支持向量机模型,(c)多层感知机模型,AUC为曲线下面积
图 3 3 种模型下训练集和测试集的 ROC 曲线
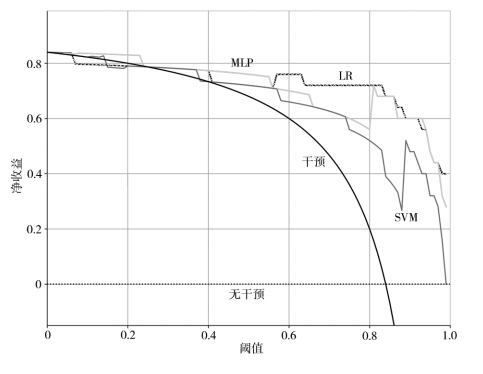
注:LR 为对数几率回归,SVM 为支持向量机,MLP 为多层感知机,DCA 为决策曲线
图 4 LR、SVM、MLP 模型下的 DCA 曲线
3 讨论
本研究利用影像组学预测脑胶质瘤患者高低分级的诊断效能,提取 Flair、T1、T1ce 和 T2 4 个模态 MRI 的影像组学特征并进行数据融合,使用 Spearman 和 LASSO 回归筛选特征,建立 LR、SVM、MLP 3 种机器学习模型进行分类预测。ROC曲线分析显示,3 种模型均具有较好的诊断效能,在训练集和测试集上AUC均 > 0.9,最高为 0.976,且灵敏度和特异度相对稳定。DCA 分析显示,3 种模型曲线在 0.2 ~ 1.0 阈值下处于干预和无干预曲线上方,在相同阈值下的净收益更高,表明 3 种模型均具有较好的临床收益。
本研究对脑胶质瘤高、低分化的影像组学研究发现,4 种模态特征联合 LR 机器学习模型在测试集中的AUC值最高,具有最佳的诊断效能。
传统 MRI 影像诊断模式诊断结果差异性较大,无法满足临床精确诊断的需求。目前大量研究将影像组学方法用于脑胶质瘤的分级诊断中。Zhou等 [11] 使用 T1 增强 MRI 影像组学预测脑胶质瘤分级,AUC为 0.95。阮君等 [12] 使用 T1、T2、T1 加权增强和弥散加权成像 4 个模态 MRI 影像组学特征评估脑胶质瘤高低分级,结果显示,基于 T1、T2 和 DWI 影像组学特征模型的 AUC均 > 0.9[12]。戴宏等 [13] 尝试对脑胶质瘤Brats19 公开数据集分级,并使用集成学习投票机制综合 3 种机器学习算法模型分类,其集成模型在测试集上的 AUC、准确度、灵敏度分别为 0.933、0.886 和 0.872。本研究 LR 模型的AUC、准确度、灵敏度分别为 0.976、0.905 和 1.000,说明 LR 模型对脑胶质瘤分化的识别准确度更佳。
综上所述,基于多模态 MRI 影像组学特征可快速、准确预测脑胶质瘤的高低分化,为临床医师对脑胶质瘤的分级诊断提供参考依据。
【参考文献】
[1]Louis DN, Perry A, Reifenberger G, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary[J]. Acta Neuropathologica, 2016, 131: 803-820.
[2]Bush NAO, Hervey-Jumper SL, Berger MS. Management of g lioblastoma , present a nd future [J ]. World Neurosurgery, 2019, 131: 328-338.
[3]韩梦婷,孙振亮 . 脑胶质瘤的治疗现状 [J]. 中国基层医药,2021,28(10):1596-1600.
[4]王伟,沈龙山,程雯,等 . 基于常规 MRI 的影像学特征联合 MRS 在脑胶质瘤术前分级评估及预测术后复发的应用研究 [J].中国 CT 和 MRI 杂志,2023,21(7):15-18.
[5]Zhang L, Yang L, Wen L, et al. Noninvasively evaluating the grading of glioma by multiparametric magnetic resonance imaging[J]. Acad Radio, 2021, 28(5): e137-e146.
[6]李洁,刘光耀,樊凤仙,等.深度学习和影像组学在脑胶质瘤中的研究进展 [J]. 磁共振成像,2022,13(4):158-161.
[7]魏焕焕,杨燕,付芳芳,等 . 基于多模态 MRI 影像组学与深度学习的脑胶质瘤诊断及预后预测研究进展 [J]. 磁共振成像,2023,14(5):175-180.
[8]Sahli H, Ben Slama A, Zeraii A, et al. ResNet-SVM: Fusion based glioblastoma tumor segmentation and classification[J]. J Xray Sci Technol, 2023, 31(1): 27-48.
[9]Alhasan AS. Clinical applications of artificial intelligence, machine learning, and deep learning in the imaging of gliomas: a systematic review[J]. Cureus, 2021, 13(11): e19580.
[10]He J, Ren J, Niu G, et al. Multiparametric MR radiomics in brain glioma: models comparation to predict biomarker status[J]. BMC Med Imaging, 2022, 22(1): 137.
[11]Zhou H, Xu R, Mei H, et al. Application of enhanced T1WI of MRI Radiomics in Glioma grading[J]. Int J Clin Pract, 2022: 3252574.
[12]阮君,张晓琦,刘文涛,等 . 基于多模态 MRI 影像组学在胶质瘤分级预测中的应用:多中心验证研究 [J]. 临床放射学杂志,2022,41(8):1408-1415.
[13]戴宏,符冉迪,金炜 . 基于影像组学与集成学习的脑胶质瘤分级预测 [J]. 宁波大学学报(理工版),2021,34(4):28-34.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号