发布时间:2023-03-10 09:37:18 浏览 次
作者:韩晓鹏(通信作者),黄艳春,冯磊,梁振士
单位:北京市医疗器械检验研究院
〔关键词〕体外诊断;运动零部件;安全
〔中图分类号〕TH776 〔文献标识码〕B
〔文章编号〕1002-2376(2023)04-0040-04
随着体外诊断医用设备的自动化程度不断提高,很多机械操作都可由设备自动完成,这在很大程度上减少了操作者的工作量。完成这些自动化操作的部件属于运动零部件,如样本/试剂针、机械臂、转盘、传动皮带以及齿轮等,尽管不是所有运动零部件都会给操作者带来伤害,但仍存在一定的安全隐患,如样本针可能会刺破操作者手指,造成物理损伤的同时还可能伴有感染的风险;机械臂运行过程中可能挤伤操作者的肢体。
为避免这些安全方面的危险,体外诊断医用设备中运动零部件需要在设计上满足相关标准中的安全要求。但在日常检测工作中发现,部分设备制造商并不了解相关标准中有关运动零部件的安全要求,因而在产品检验过程中出现不符合项目而面临整改;还有一些制造商在产品设计时参考了同类产品,尤其对运动零部件的防护要求认识不准确,这显然会制约后续的产品创新。基于上述实际情况,有必要对相关标准中运动零部件的安全要求进行说明。本研究将对体外诊断医用设备适用的国内安全标准及IEC标准中关于运动零部件的安全要求进行介绍。
1 国内安全标准对运动零部件的安全要求
目前,体外诊断医用设备在安全方面通常需要满足GB 4793.1-2007《测量、控制和实验室用电气设备的安全要求 第1部分:通用要求》[1]、GB 4793.9-2013《测量、控制和实验室用电气设备的安全要求 第9部分:实验室用分析和其他目的自动和半自动设备的特殊要求》[2]和YY 0648-2008《测量、控制和实验室用电气设备的安全要求第2-101部分:体外诊断(IVD)医用设备的专用要求》[3]这3份标准的要求(需要说明的是,由于某些体外诊断医用设备集成有其他功能,如加热、混合搅拌等,除前述3份标准外,还需满足对应安全标准的要求,且这些标准中也可能存在对运动零部件的安全要求,在本研究的叙述中并未涉及这些标准中对运动零部件的安全要求;为叙述方便,下文中提及上述3份标准的编号时均不再注明年份)。GB 4793.1 是通用安全标准,这里的“通用”是指它适用于所有“测量、控制和实验室用电气设备”;GB 4793.9和YY 0648是两份专用安全标准,这里的“专用”是指它适用于“测量、控制和实验室用电气设备”中的某一类设备,具体来说,GB 4793.9适用于实验室用分析和其他目的自动和半自动设备,YY 0648适用于体外诊断医用设备。专用安全标准会根据其所适用设备特点对通用标准中的要求进行修改,必要时还会增加一些新要求,因此,专用标准需与通用标准结合起来使用。GB 4793.1中7.2的第一段(GB 4793.9删除了GB 4793.1中7.2的第二段和第三段,仅保留了第一段)以及GB 4793.9中7.2.101和7.2.102规定了对运动零部件的要求,YY 0648直接引用了GB 4793.1中的内容,并未提出新的要求。因此,我们只需要关注GB 4793.1和GB 4793.9这两份标准即可。
如图1所示,运动零部件符合性评定的流程图将标准要求以及这些标准之间的关系直观地呈现出来,可更好地理解标准要求。“正常使用时是否可触及”是指操作者按照使用说明书内容操作设备实现预期用途的过程中是否会触及到运动零部件,通常使用说明书不会要求操作者主动接触运动零部件去完成某一项操作,因此,这里指的是在操作过程中操作者是否会意外触及到运动零部件。“正常使用之外是否可触及”是指操作者按照使用说明书进行维护时,不得不去接触可能会引起危险的运动零部件才能完成某种程序。由于这种操作存在危险性,通常情况下,制造商会规定此类维护操作只能由其授权的专业人员来执行,而不允许操作者来执行,在这种情况下,GB 4793.9中7.2.102是不适用的;反之,如果制造商规定此类维护操作可由操作者来执行,则应进行符合性评定。“运动零部件的暴露是否不可避免”的判断容易被忽略掉,它出现在GB 4793.9的7.2.101中,尽管在体外诊断医用设备适用的最新IEC标准中不再需要进行这一判断,但考虑到国内的标准是现行有效的,此处还是有必要解释一下:将某运动零部件移动构成的空间区域称为A区域,操作者按照使用说明书操作设备从而实现预期用途的过程中,整个身体移动构成的空间区域称为B区域,如A区域和B区域无交集,则该运动零部件的暴露被认为是可避免的;反之,A区域和B区域有交集,则该运动零部件的暴露被认为是不可避免的。如果某运动零部件的暴露被认为是不可避免的,一种方法是采取措施(如减弱作用力、减少作用时间、降低速度、增大接触面积及接触面选择柔软的材质等)使得运动零部件不会挤破、划破、刺破或严重夹伤操作者;另一种方法是通过GB 4793.9中7.2.101规定的风险管理方法将运动零部件产生的风险降低至可接受水平,标准中按照优先级从高到低列举了6种保护措施,分别是保护装置(联锁系统或其他方法,只有使用工具才能移除)、
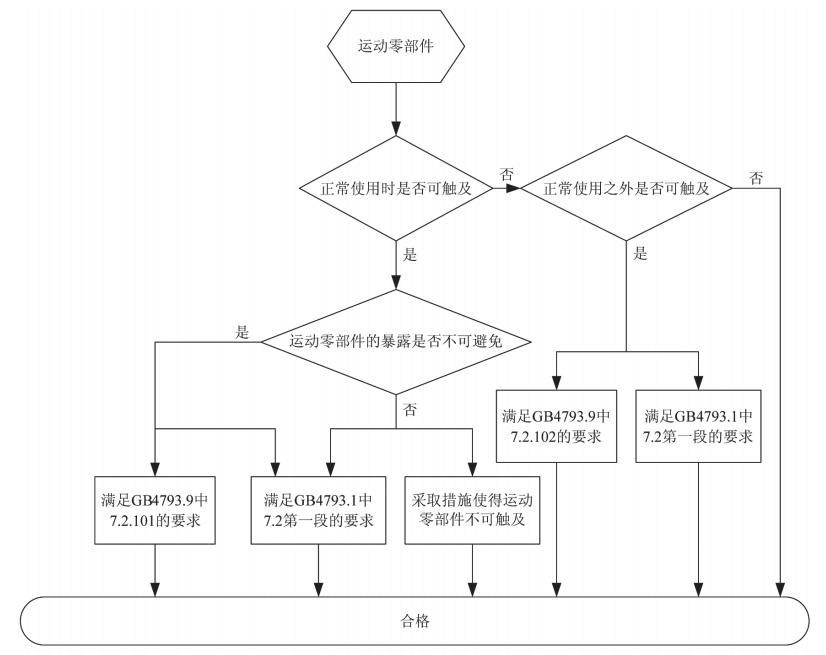
图1 按国内标准对运动零部件的符合性进行评定的流程图
保护罩、机械挡板、安全区域和运动零部件间有足够的距离、警告信号(听觉或视觉)、警告标志,保护措施的效果从前到后依次降低。因此,标准给这些保护措施按优先级排列了顺序,优先采用排列在前面的保护措施,但标准原意并未强制要求必须采取哪种保护措施,而是允许制造商根据实际情况选择合适的保护措施。通常情况下,对于高风险的运动零部件,应采取联锁系统及防护罩等措施来降低风险;而对于低风险的运动零部件,可采取加贴警告标志的措施来降低风险。如需获得更多指导,可参考体外诊断医用设备适用的最新IEC标准,这些标准对运动零部件的风险评定作了更详细的规定。
2 IEC标准对运动零部件的安全要求
目前,体外诊断医用设备适用的最新IEC安全标准为2017年发布的IEC 61010-1第3.1版[4]和2018年发布的IEC 61010-2-101第3.0版[5],前者是测量、控制和实验室用电气设备的通用安全要求,后者是体外诊断医用设备的专用安全要求。对于实验室用分析和其他目的自动和半自动设备,IEC标准的最新版本为2019年发布的IEC 61010-2-081第3.0版[6],其中明确指出体外诊断医用设备不适用于该标准。新版GB 4793.9是从IEC 61010-2-081的3.0版等同转化而来的,待新版GB 4793.9发布实施后,体外诊断医用设备无需再执行新版GB 4793.9的要求。考虑到国内体外诊断医用设备的安全标准都是从IEC标准转化过来的,且国内现行标准预计在近几年内会陆续换版,故提前了解IEC标准中的相关要求是很有必要的。
IEC标准对运动零部件的符合性进行评定,与国内现行有效的标准相比,IEC标准增加了一些新的内容(图2)。IEC 61010-1中7.3.3部分规定了运动零部件给人体造成的机械危险进行风险评定标准,其中引用了IEC 61010-1中的表12,该表对危险严重程度、暴露于危险的概率、躲避危险的概率以及保护措施的类型进行了分级,并对每个级别给出了具体的定义或说明。制造商结合自身产品中运动零部件的特点,通过查表就可采取相应的保护措施来降低风险。IEC 61010-1中7.3.4部分给出了力和压强的限制,最大允许的连续接触压强是50N/cm2,同时力不能超过150N;身体不小于3cm2的接触面积上允许的短时最大作用力是250N,持续时间不超过0.75s,低于上述限值的运动零部件产生的风险被认为是可接受的。IEC61010 -1中7.3.5部分对运动零部件之间的间隙给出了限值,限值分为两类,一类是允许进入的间隙限值,如标准规定如果运动零部件之间的间隙始终大于等于120mm,则认为手臂不会受到该运动零部件的挤压,标准也分别给出了躯干、头、腿、脚、脚趾、手、腕、拳以及手指免受挤压的间隙尺寸;另一类是不允许进入的间隙限值,如标准规定如果运动零部件之间的间隙始终小于等于4mm,则认为手指不会进入该间隙,也就不会受到该运动零部件的挤压。如运动零部件满足上述两类间隙的限值,则认为运动零部件产生的风险是可接受的。IEC 61010-2-101中7.3.101部分专门为样本区规定了安全要求,如制造商规定设备用于连续加载样本和试剂材料,且在样本区的相关危险仅由样本和/或试剂针引起,则样本区适用7.3.101的要求(需要注意的是,7.3.101不适用于自测和床边检测设备)。
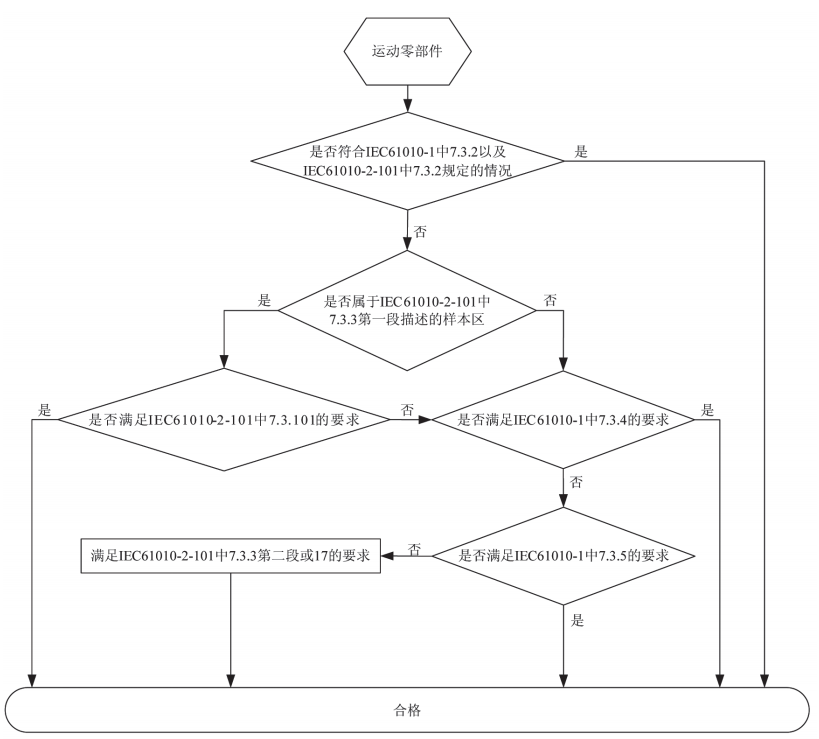
图2 按 IEC 标准对运动零部件的符合性进行评定的流程图
3 总结
对于体外诊断医用设备来说,与运动零部件相关的安全风险不同于电击危险那样被大家所熟知,但若在设计上对运动零部件的风险不加以控制,设备的操作者可能会面临机械损伤的风险,本研究对标准的介绍能够作为相关人员更好地理解标准要求的参考,以便其设计出符合要求的产品。
【参考文献】
[1]中华人民共和国国家质量监督检验检疫总局 . GB 4793.1-2007 测量、控制和实验室用电气设备的安全要求 第1部分:通用要求 [S]. 北京:中国标准出版社,2007.
[2]中华人民共和国国家质量监督检验检疫总局 , 中国国家标准化管理委员会 . GB 4793.9-2013 测量、控制和实验室用电气设备的安全要求 第9 部分:实验室用分析和其他目的自动和半自动设备的特殊要求 [S]. 北京:中国标准出版社,2014.
[3]国家食品药品监督管理局 . YY 0648-2008 测量、控制和实验室用电气设备的安全要求 第2-101部分:体外诊断(IVD)医用设备的专用要求 [S]. 北京:中国标准出版社,2008.
[4]IEC/TC66.IEC 61010-1 Edition 3.1 Safety requirements for electrical equipment for measurement, control, and laboratory use - Part 1: General requirements[S].Geneva Switzerland: IEC, 2017. https://webstore.iec.ch/publication/59769.
[5]IEC/ TC66.IEC 61010-2-101 Edition 3.0 Safety requirements for electrical equipment for measurement, control, and laboratory use-Part 2-101: Particular requirements for in vitro diagnostic (IVD) medical equipment[S]. Geneva Switzerland: IEC, 2018. https:// webstore.iec.ch/publication/63969.
[6]IEC/ TC66.IEC 61010-2-081 Edition 3.0 Safety requirements for electrical equipment for measurement, control, and laboratory use-Part 2-081: Particular requirements for automatic and semi-automatic laboratory equipment for analysis and other purposes[S]. Geneva Switzerland: IEC, 2019. https://webstore.iec.ch/publication/64668.
内容来源于《医疗装备》杂志,如需转载请注明出处。

欢迎关注《医疗装备》官方公众号